
【题目】H2SiF6(氟硅酸)是一种基本化工原料,广泛用于制取氟硅酸盐及氟化物等。以氟硅酸和碳酸锂等为原料生产电池级LiF的工艺流程如图:
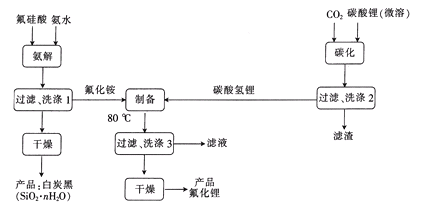
回答下列问题:
(1)生产中采用内衬为聚四氟乙烯或石墨的反应器。聚四氟乙烯的结构简式为____;不用陶瓷设备的原因是____。
(2)“氨解”时发生反应的化学方程式为____,氟化铵的电子式为____。
(3)“碳化”时发生反应的离子方程式为____。
(4)“制备”时产生的气体经分别吸收后返回____和___工序循环使用。
(5)H2SiF6水溶液中存在平衡:SiF62-(aq)+4H2O(1)═Si(OH)4(aq)+4H+(aq)+6F-(aq),该反应的平衡常数表达式为___。
(6)某工厂用纯度为85%的氟硅酸14.4吨和纯度为90%的碳酸锂7.4吨来制备氟化锂,已知流程中氟元素的损耗率为10%,锂元素的损耗率为8%,则最终产品氟化锂为____吨(精确到0.1)。
【答案】![]() —CF2一CF2
—CF2一CF2![]() F-水解生成的HF能与硅酸盐陶瓷中的SiO2反应 H2SiF6+6NH3·H2O=6NH4F+SiO2·nH2O↓+(4-n)H2O(或H2SiF6+6NH3·H2O=6NH4F+SiO2↓+4H2O)
F-水解生成的HF能与硅酸盐陶瓷中的SiO2反应 H2SiF6+6NH3·H2O=6NH4F+SiO2·nH2O↓+(4-n)H2O(或H2SiF6+6NH3·H2O=6NH4F+SiO2↓+4H2O) 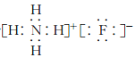 Li2CO3+CO2+H2O=2Li++
Li2CO3+CO2+H2O=2Li++![]() 氨解 碳化
氨解 碳化 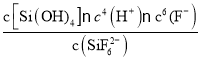 4.3
4.3
【解析】
(1)聚四氟乙烯的单体CF2=CF2,加聚得![]() —CF2一CF2
—CF2一CF2![]() ;F-、HF均能与SiO2反应。
;F-、HF均能与SiO2反应。
(2)“氨解”时,反应物为H2SiF6、NH3·H2O,生成物为NH4F、SiO2·nH2O和H2O,然后写出并配平化学方程式。氟化铵是![]() 和F-构成的离子化合物,电子式为
和F-构成的离子化合物,电子式为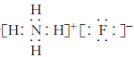 。
。
(3)碳化时发生的反应为Li2CO3+CO2+H2O=2LiHCO3,LiHCO3写成离子形式。
(4)“制备”反应:NH4F+LiHCO3![]() LIF+CO2↑+NH3↑+H2O,NH3被吸收制取氨水返回“氨解”工序,CO2回收返回“碳化”工序。
LIF+CO2↑+NH3↑+H2O,NH3被吸收制取氨水返回“氨解”工序,CO2回收返回“碳化”工序。
(6)1mol H2SiF6中含6mol F-,1mol Li2CO3中只含2mol Li+,由上述数据可以得出H2SiF6过量,按碳酸锂计算。
(1)聚四氟乙烯的单体CF2=CF2,加聚得![]() —CF2一CF2
—CF2一CF2![]() ;陶瓷设备中含有SiO2,F-、HF均能与SiO2反应。
;陶瓷设备中含有SiO2,F-、HF均能与SiO2反应。
(2)“氨解”时,反应物为H2SiF6、NH3·H2O,生成物为NH4F、SiO2·nH2O和H2O,然后写出并配平化学方程式: H2SiF6+6NH3·H2O=6NH4F+SiO2·nH2O↓+(4n)H2O(或H2SiF6+6NH3·H2O=6NH4F+SiO2↓+4H2O)。氟化铵是![]() 和F-构成的离子化合物,电子式为
和F-构成的离子化合物,电子式为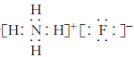 。
。
(3)“碳化”时发生反应:Li2CO3+CO2+H2O=2LiHCO3,LiHCO3写成离子形式。“碳化”时发生反应的离子方程式为:Li2CO3+CO2+H2O=2Li++![]() ;
;
(4)“制备”反应:NH4F+LiHCO3![]() LIF+CO2↑+NH3↑+H2O,NH3被吸收制取氨水返回“氨解”工序,CO2回收返回“碳化”工序。
LIF+CO2↑+NH3↑+H2O,NH3被吸收制取氨水返回“氨解”工序,CO2回收返回“碳化”工序。
(5)SiF62-(aq)+4H2O(1)═Si(OH)4(aq)+4H+(aq)+6F-(aq),该反应的平衡常数表达式为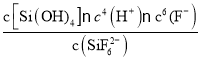 ;
;
(6)1mol H2SiF6中含6mol F-,1mol Li2CO3中只含2mol Li+,由上述数据可以得出H2SiF6过量,按碳酸锂计算,m(LiF)=2×7.4t×90%×92%×26g·mol-1÷74g·mol-1=4.3t。


科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物分子中的碳碳双键发生臭氧氧化反应: ,有机物A的结构简式为
,有机物A的结构简式为 ,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:

(1)下列说法正确的是 ______ 。(填字母序号)
A.C的官能团为羧基
B.1molA最多可以和2molNaOH反应
C.C可以发生氧化反应、取代反应和加成反应
D.![]() 可以发生消去反应
可以发生消去反应
(2)F的结构简式为____________ ,由F到G的反应类型为___________ 。
(3)反应①的作用是__________________ ,合适的试剂a为____________。
(4)同时满足下列条件的A的一种同分异构体的结构简式______________________。
Ⅰ.与A具有相同的官能团;Ⅱ.属于苯的邻二取代物;Ⅲ.能使FeCl3溶液显色;Ⅳ.核磁共振氢谱分析,分子中有8种不同化学环境的氢原子。
(5)H与G分子具有相同的碳原子数目,且1molH能与足量的新制银氨溶液反应生成4mol单质银。写出H与足量的新制银氨溶液反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.84 g的铜加入100 mL H2SO4和HNO3混合液中,铜全部溶解并放出无色气体。向溶液中加入2.70 g铝粉,充分反应后过滤,得到溶液X、滤渣Y和气体Z,气体Z遇空气不变色,在标准状况下的体积为672 mL。下列说法正确的是
A. 溶解铝粉的质量为0.54 g
B. 滤渣Y中可能只含有Cu
C. 原混合液中的c(H2SO4):c(HNO3)=9:4
D. 若向溶液X中加入100 mL 2.0 mol·L-1氢氧化钠溶液,充分反应,所得沉淀为4.68 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是

A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)═C2H4(g)△H1=-174.3kJ·mol—1
K1(300K)=3.37×1024
C2H2(g)+2H2(g)=C2H6(g)△H2═-311.0kJ·mol一l
K2(300K)═1.19×1042
则反应C2H4(g)+H2(g)═C2H6(g)的△H=___kJ·mol一1,K(300K)=__(保留三位有效数字)。
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。
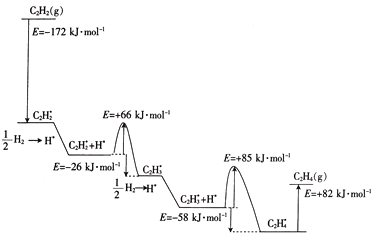
上述吸附反应为____(填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____kJ·mol-1,该步骤的化学方程式为____。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)C2H2(g)+H2(g)。乙烯的离解率为a,平衡时容器内气体总压强为P总,则分压p(C2H4)═___(用p总和a表示)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。
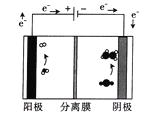
该分离膜为___(填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度、体积的密闭容器中,可逆反应A(s)+3B(g)![]() 2C(g)达到平衡时,下列说法能判断该反应达到平衡的是( )
2C(g)达到平衡时,下列说法能判断该反应达到平衡的是( )
①C的生成速率和C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③混合气体的密度不再变化
④混合气体的总压强不再变化
⑤A、B、C物质的量之比为1∶3∶2
⑥混合气体的平均相对分子质量不变
⑦容器中C的体积分数不变
A.②④⑤⑦B.①③④⑥⑦C.①④⑥⑦D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+ O2(g)![]() 2SO3(g),△H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,并在400℃条件下开始反应,达到平衡时,下列说法正确的是( )
2SO3(g),△H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,并在400℃条件下开始反应,达到平衡时,下列说法正确的是( )

A. 容器I、Ⅲ中平衡常数相同
B. 容器II、Ⅲ中正反应速率始终相同
C. 容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II<III
D. 容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com