
����Ŀ����ͼ�Т١�����Ԫ�����ڱ��е�ǰ��������Ӧ��Ԫ�أ������ѡ����ʵ�Ԫ�ػش����⣺
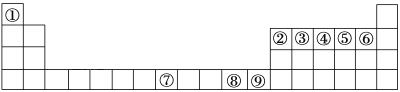
(1)����Ԫ��ԭ�ӵ���Χ�����Ų�������Ԫ�����ڱ��ɻ���Ϊ�������Ԫ��λ�����ڱ���________����Ԫ�آ�ļ۵����Ų�ʽΪ___________��
(2)�ڡ�����Ԫ���γɵĻ���������幹��Ϊ________��������ԭ�ӵ��ӻ��������Ϊ____________��
(3)Ԫ�آ���CO���γ�X(CO)5�ͻ�����û����ﳣ���³�Һ̬���۵�Ϊ-20.5 �棬�е�Ϊ103 �棬�����ڷǼ����ܼ����ݴ˿��жϸû����ᄃ������_______����(�������)��Ԫ�آߵ�δ�ɶԵ�����Ϊ_____����
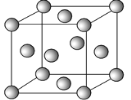
(4)Ԫ�آ�Ķ���������������Ģܵ��⻯���ˮ���ﷴӦ�����ӷ���ʽΪ_____��Ԫ�آ�ĵ��ʵľ����ṹ��ͼ����֪�������ⳤΪa cm��NAΪ�����ӵ���������þ�����ܶ�Ϊ______g/cm3(��a��NA��ʾ)��
���𰸡�s 3d104s2 ƽ���������� sp2�ӻ� ���� 4 Cu2����4NH3��H2O=[Cu(NH3)4]2����4H2O ![]()
��������
����Ԫ�����ڱ���λ�ã���ΪH����ΪB����ΪC����ΪN����ΪO����ΪF����ΪFe����ΪCu����ΪZn��������ʽṹ�;����ļ��㷽���������
(1)��ΪH�������ֻ��һ�����ӣ�λ��s����Ԫ�آ�ΪZn��Ϊ30��Ԫ�أ��۵����Ų�ʽΪ3d104s2���ʴ�Ϊ��s��3d104s2��
(2)�ڡ�����Ԫ���γɵĻ�����ΪBF3��B�γ�3���������¶Ե�����Ϊ=![]() =0��B����sp2�ӻ���BF3���幹��Ϊƽ���������Σ��ʴ�Ϊ��ƽ���������Σ� sp2�ӻ���
=0��B����sp2�ӻ���BF3���幹��Ϊƽ���������Σ��ʴ�Ϊ��ƽ���������Σ� sp2�ӻ���
(3)Ԫ�آ���CO���γ�Fe(CO)5�ͻ�����û����ﳣ���³�Һ̬���۷е�ϵͣ����Ϸ��Ӿ������������Ϊ26��Ԫ�أ������Ų�ʽΪ1s22s22p63s23p63d64s2��3d����4��δ�ɶԵ��ӣ��ʴ�Ϊ�����ӣ�4��
(4)Ԫ�آ�Ķ���������ΪCu2+���ܵ��⻯���ˮ����ΪNH3H2O��Cu2+�����NH3H2O��Ӧ������������[Cu(NH3)4]2+��ˮ�������ӷ���ʽΪ��Cu2++4NH3H2O�T[Cu(NH3)4]2++4H2O��������ͭԭ����Ŀ=8��![]() +6��
+6��![]() =4����������=
=4����������=![]() g���������=a3cm3����þ�����ܶ�
g���������=a3cm3����þ�����ܶ�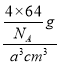 =
=![]() g/cm3���ʴ�Ϊ��Cu2++4NH3H2O�T[Cu(NH3)4]2++4H2O��
g/cm3���ʴ�Ϊ��Cu2++4NH3H2O�T[Cu(NH3)4]2++4H2O��![]() ��
��


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3.84 g��ͭ����100 mL H2SO4��HNO3���Һ�У�ͭȫ���ܽⲢ�ų���ɫ���塣����Һ�м���2.70 g���ۣ���ַ�Ӧ����ˣ��õ���ҺX������Y������Z������Z����������ɫ���ڱ�״���µ����Ϊ672 mL������˵����ȷ����
A. �ܽ����۵�����Ϊ0.54 g
B. ����Y�п���ֻ����Cu
C. ԭ���Һ�е�c(H2SO4):c(HNO3)��9:4
D. ������ҺX�м���100 mL 2.0 mol��L��1����������Һ����ַ�Ӧ�����ó���Ϊ4.68 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶ȡ�������ܱ������У����淴ӦA(s)+3B(g)![]() 2C(g)�ﵽƽ��ʱ������˵�����жϸ÷�Ӧ�ﵽƽ����ǣ� ��
2C(g)�ﵽƽ��ʱ������˵�����жϸ÷�Ӧ�ﵽƽ����ǣ� ��
��C���������ʺ�C�ķֽ��������
�ڵ�λʱ��������amolA��ͬʱ����3amolB
�ۻ��������ܶȲ��ٱ仯
�ܻ���������ѹǿ���ٱ仯
��A��B��C���ʵ���֮��Ϊ1��3��2
��������ƽ����Է�����������
��������C�������������
A.�ڢܢݢ�B.�٢ۢܢޢ�C.�٢ܢޢ�D.�٢ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������һ�ű���ֽƬ��Ϊ�����壬һ���Zn����һ���MnO2������ܷ�ӦΪZn+2MnO2+H2O=2MnO(OH)+ZnO������˵����ȷ���ǣ� ��
A.�õ�ص�����ΪZnO
B.Zn�缫������Һ��pH����
C.��������ĵ缫��ӦΪ2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.��0.1molZn��ȫ�ܽ�ʱ���������Һ�ĵ��ӵ����ʵ���Ϊ0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������࣬�ṹ���ӡ�
��1�����и�ͼ���ܱ�ʾ����ķ��ӽṹ�����м�������ģ����__(����ţ���ͬ)�����ּ���Ŀռ���ʵ�ṹ��__��


��2�������л���������ԭ�ӿ�����ͬһ��ƽ���ϵ���___������ţ�

��3����ͼ����4��̼ԭ�ӽ�ϳɵ�6���л���(��ԭ��û�л���)

�������л�������(c)��Ϊͬ���칹�����__(�����)��
������(a)������__��
���л���(a)��һ��ͬ���칹�壬��д����ṹ��ʽ__��
��д����(c)��Ϊͬϵ�������л������ˮ��Ӧ�Ļ�ѧ����ʽ��__���������������___��
��4��ij��ϩ���������ӳɺ����������飬��ϩ���Ľṹ��ʽ��__�֡�
��5���������顱��һ���ºϳɵ����������Ϊ������ṹ����ͼ��ʾ�����飬�������ÿ��������һ��̼ԭ�ӣ���ԭ�Ӿ�ʡ�ԣ�һ�����߱�ʾһ�����õ��Ӷԡ�̼ԭ���ϵĶ�����ԭ�ӱ�������-NH2��ȡ����ͬ���칹�����Ŀ��_�֡�
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������ܱ������н��еĿ��淴ӦA(g)+ 3B(g)![]() 2C(g)�� ����˵����֤����һ ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
2C(g)�� ����˵����֤����һ ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬����
A.����C��������ֽ�C���������.
B.A. B��C�ķ�����֮��Ϊ1:3:2
C.A��B��C��Ũ�����
D.��λʱ������nmolA��ͬʱ����2nmolC
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������´��ڷ�Ӧ��2SO2(g)+ O2(g)![]() 2SO3(g)����H��0���������������ͬ���ܱ���������400�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����(����)
2SO3(g)����H��0���������������ͬ���ܱ���������400�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����(����)

A. ����I������ƽ�ⳣ����ͬ
B. ����II����������Ӧ����ʼ����ͬ
C. �������еķ�Ӧ��ƽ��ʱ��SO3�����������II<III
D. ����I��SO2��ת��������������SO3��ת����֮��С��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ����
A. ��0.1mol/LCH3COOH��Һ�м�������ˮ����Һ��c(H+)/c(CH3COOH)��С
B. ��CH3COONa��Һ��20��������30�棬��Һ��c(CH3COO-)/c(CH3COOH)��c(OH��)����
C. �������м��백ˮ�����ԣ���Һ��c(NH4+)/c(Cl��)��1
D. ��AgCl��AgBr�ı�����Һ�м�����������������Һ��c(Cl��)/c(Br��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�ʹ2molN2��6molH2��Ϸ������з�Ӧ��
N2��g��+3H2��g��![]() 2NH3��g�� ��H<0
2NH3��g�� ��H<0
��1������Ӧ�ﵽƽ��ʱ�� N2��H2��ת���ʱ��� ��
��2�����ﵽƽ��ʱ����c(N2)��c(H2)��c(NH3)ͬʱ��Сһ����ƽ�⽫�� �ƶ���������������ҡ���������
��3�����ﵽƽ��ʱ�����������������ѹǿ���䣬ƽ�⽫��___________�ƶ���
��4������������������������ʹ�������¶�Ѹ������ԭ����2����ƽ�⽫___________�ƶ������ ���������ҡ����������ﵽ��ƽ����������¶� ������ڡ�����С�ڡ����ڡ���ԭ����2����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com