
【题目】有机物种类繁多,结构复杂。
(1)下列各图均能表示甲烷的分子结构,其中甲烷的球棍模型是__(填序号,下同),表现甲烷的空间真实结构是__。


(2)下列有机物中所有原子可以在同一个平面上的是___(填序号)

(3)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)

①上述有机物中与(c)互为同分异构体的是__(填序号)。
②写出有机物(a)的名称__。
③有机物(a)有一种同分异构体,试写出其结构简式__。
④写出与(c)互为同系物的最简单有机物和溴水反应的化学方程式:__;生成物的名称是___。
(4)某单烯烃与氢气加成后生成异戊烷,该烯烃的结构简式有__种。
(5)“立方烷”是一种新合成的烃,其分子为正方体结构。如图表示立方烷,正方体的每个顶点是一个碳原子,氢原子均省略,一条短线表示一个共用电子对。碳原子上的二个氢原子被氨基(-NH2)取代,同分异构体的数目有_种。
![]()
【答案】C D ABD bf 异丁烷 CH3CH2CH2CH3 CH2=CH2+Br2→CH2Br-CH2Br 1,2-二溴乙烷 3 3
【解析】
(1)甲烷的球棍模型是C,甲烷的电子式是B;A是分子结构示意图;D是比例模型;其中比例模型更能形象地表达出H、C的相对位置及所占比例;电子式只反映原子最外层电子的成键情况;
(2)乙烯和苯分子中所有原子共平面,甲烷是正四面体结构,所以C不可能原子共面;D苯环和碳碳双键之间的碳碳单键可以旋转,所有原子可以共平面;
(3)①c为C4H8与它分子式相同,结构不同的为b、f,
②由图示可知a为烷烃,含有4个C原子,主链含有3个C,甲基在2号C,是异丁烷
③含有4个碳原子的烷烃有CH3CH(CH3)CH3和CH3CH2CH2CH3,a为CH3CH(CH3)CH3,则其同分异构体为:CH3CH2CH2CH3;
④c为丁烯,单烯烃碳原子数目最少的是CH2=CH2;
(4)加成反应不改变碳链结构,异戊烷CH3-CH2-CH(CH3)2两个甲基与碳相连的价键是相同的,所以烯烃的双键位置有三种,烯烃的结构就有三种;
(5)在一个面上有邻位和对位两种;不在一个面上,有1种,即立方体体对角线一个顶点一个-NH2。共3种。



 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,下列说法正确的是
A. 3gCO2中含有的质子数为1.5NA
B. 1L0.1mol·L-1 Na2SiO3溶液中含有的SiO32-数目为0.1NA
C. 0.1molH2O2分解产生O2时,转移的电子数为0.2NA
D. 2.8g聚乙烯中含有的碳碳双键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。
M | N | ||
X | Y |
(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为____________________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_______________________________________________________________________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 17 |
化学式 | ___________ | ________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其平衡常数为K1,化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1,化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其平衡常数为K2,在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
请完成下列问题:
(1)通过表格中的数值可以推断:反应①是______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=_______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=_______。
(3)在相同温度下,根据反应①与②可推导出K3与K1、K2之间的关系式____________,据此关系式及上表数据,也能推断出反应③是_____(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ (填写字母序号,下同).
A.增大压强 B.体积不变时充入稀有气体 C.升高温度 D.使用合适的催化剂 E.在体系中投入少量P2O5固体
(5)已知③的可逆反应CO (g) +H2O(g) ![]() CO2 (g) +H2 (g) ,830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为___________;K的数值为_____________。830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为_______。
CO2 (g) +H2 (g) ,830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为___________;K的数值为_____________。830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。下列说法正确的是( )

A.2min时,v(X)=0.075molL-1min-1
B.2min时,v(X,正)=v(Y,逆)
C.上述反应在甲、乙不同条件下同时进行,分别测得甲:v(X)=9mol·L-1·min-1,乙:v(Y)=0.1mol·L-1·s-1,则甲反应更快。
D.Z为气态,若X、Y任意一种物质是非气态,则气体密度不变说明该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中①~⑨是元素周期表中的前四周期相应的元素,请从中选择合适的元素回答问题:
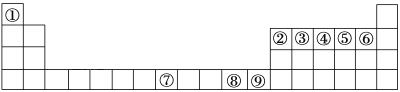
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的________区。元素⑨的价电子排布式为___________。
(2)②、⑥两元素形成的化合物的立体构型为________,其中心原子的杂化轨道类型为____________。
(3)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于_______晶体(填晶体类型)。元素⑦的未成对电子数为_____个。
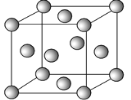
(4)元素⑧的二价阳离子与过量的④的氢化物的水化物反应的离子方程式为_____。元素⑧的单质的晶胞结构如图:已知晶胞的棱长为a cm,NA为阿伏加德罗常数,则该晶体的密度为______g/cm3(用a、NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 常温常压下,31 g P4中含P-P键的数目为NA
B. 常温常压下,46 g NO2与92 g N2O4所含的分子数相同
C. 一定条件下,6.4 g铜粉与过量的硫粉充分反应,转移电子数为0.2 NA
D. 标准状况下,将22.4 L Cl2 通入足量NaOH溶液中,转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应![]() 达到平衡,若:
达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则![]() ____(填“>”“<”或“=”)p。
____(填“>”“<”或“=”)p。
(2)A、C是气体,而且![]() ,增大压强可使平衡发生移动,则平衡移动的方向是__________。
,增大压强可使平衡发生移动,则平衡移动的方向是__________。
(3)加热后,可使C的质量增加,则正反应是__________(填“放热”或“吸热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com