
【题目】NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 常温常压下,31 g P4中含P-P键的数目为NA
B. 常温常压下,46 g NO2与92 g N2O4所含的分子数相同
C. 一定条件下,6.4 g铜粉与过量的硫粉充分反应,转移电子数为0.2 NA
D. 标准状况下,将22.4 L Cl2 通入足量NaOH溶液中,转移电子数为NA
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】有机物的分类,乙醛(CH3CHO)属于醛。下面各项对有机物的分类方法与此方法相同的是
①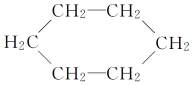 属于环状化合物
属于环状化合物
②![]() 属于卤代烃
属于卤代烃
③![]() 属于链状化合物
属于链状化合物
④ 属于醚
属于醚
A. ①② B. ②③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+=Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是

A.电源的X极为正极,Y极为负极
B.阴极的电极反应式为Fe2+-e-=Fe3+
C.阳极的电极反应式为H2O-e-=H++·OH
D.每消耗1molO2,整个电解池中理论上可产生2mol·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1mol/LAlCl3溶液中,含![]() 数目小于
数目小于![]()
B. 25℃,![]() pH=1的稀硫酸中含有的
pH=1的稀硫酸中含有的![]() 数为
数为![]()
C. 标准状况下,![]()
![]() 和
和![]() 混合气体中含
混合气体中含![]() 个原子
个原子
D. 由![]()
![]() 和少量
和少量![]() 形成的中性溶液中,CH3COO-数目为
形成的中性溶液中,CH3COO-数目为![]() 个
个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列五种物质中①Ne;②H2O;③NH3;④KOH;⑤Na2O,只存在共价键的是____,只存在离子键的是____,既存在共价键又存在离子键的是____,不存在化学键的是_____.(填写序号)
(2)现有①Na2S、②NH4Cl、③干冰、④碘片四种物质,按下列要求回答:
用电子式表示①的形成过程是_______,用电子式表示④的形成过程是___________②的电子式是________③的电子式是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用两支惰性电极插入50mLAgNO3溶液中,通电电解。当电解液的PH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是:
A. 27mg B. 54mg C. 108mg D. 216mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图所示的装置进行实验。![]() 、
、![]() 为两种常见金属,它们的硫酸盐可溶于水,当
为两种常见金属,它们的硫酸盐可溶于水,当![]() 闭合时,
闭合时,![]() 从右向左通过交换膜移向
从右向左通过交换膜移向![]() 极。下列分析不正确的是
极。下列分析不正确的是

A. 溶液中![]() 增大
增大
B. ![]() 极的电极反应:
极的电极反应:![]()
C. ![]() 电极上有
电极上有![]() 产生,发生氧化反应
产生,发生氧化反应
D. 反应初期,![]() 电极周围出现白色胶状沉淀
电极周围出现白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用湿法冶金工艺回收废旧光盘中的金属Ag(其他金属因微量忽略不计),其流程如下:
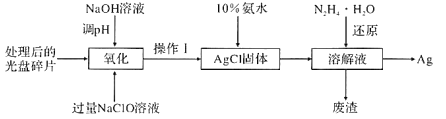
回答下列问题:
(1)①“操作I”为_____,在实验室进行此操作需要用到的玻璃仪器有_____。
②在实验室利用“操作I”的装置洗涤难溶物的操作方法是_______。
(2)若NaClO溶液与Ag反应的产物有AgCl和O2,则该反应的化学方程式为____若以稀HNO3代替NaClO溶液,其缺点是___(写出一条即可)。
(3)已知Ag2O在酸性条件下能将有毒气体甲醛(HCHO)氧化成CO2,科学家据此原理将上 述过程设计为一种电化学装置,以回收电极材料中的金属Ag。则此电池的正极反应式为_____。
(4)已知室温时,Ksp(Ag2SO4)=1.4×10-5,Ksp(AgCl)=1.8×10-10。计算反应Ag2SO4(s)+2Cl-(aq) ![]() 2AgCl(s)+SO42- (aq)的平衡常数K=_____。(保留两位有效数字)
2AgCl(s)+SO42- (aq)的平衡常数K=_____。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性![]() 溶液氧化为MnO4-,该方法可用于检验Mn2+。
溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ ![]() 可看成两分子硫酸偶合所得,若硫酸的结构式为
可看成两分子硫酸偶合所得,若硫酸的结构式为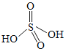 ,则
,则![]() 的结构式为_________。
的结构式为_________。
(2)实验室用含锰废料(主要成分![]() ,含有少量
,含有少量![]() )制备Mn的流程如下:
)制备Mn的流程如下:
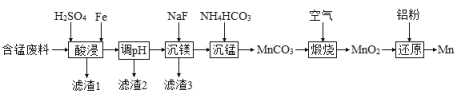
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
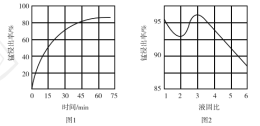
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com