
【题目】用两支惰性电极插入50mLAgNO3溶液中,通电电解。当电解液的PH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是:
A. 27mg B. 54mg C. 108mg D. 216mg
科目:高中化学 来源: 题型:
【题目】某有机物完全燃烧生成CO2和H2O。将12.4 g该有机物的完全燃烧产物通过浓硫酸,浓硫酸增重10.8 g,再通过碱石灰,碱石灰增重了17.6 g。下列说法不正确的是
A. 该有机物的最简式为CH3O
B. 该有机物的分子式可能为CH3O
C. 该有机物的分子式一定为C2H6O2
D. 该有机物可能属于醇类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种智能双模式海水电池,满足水下航行器对高功率和长续航的需求。负极为Zn,正极放电原理如图。下列说法错误的是( )
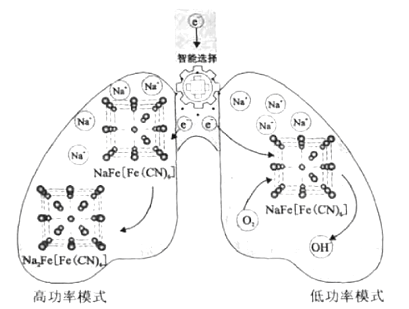
A. 电池以低功率模式工作时,NaFe[Fe(CN)6]作催化剂
B. 电池以低功率模式工作时,Na+的嵌入与脱嵌同时进行
C. 电池以高功率模式工作时,正极反应式为:NaFe[Fe(CN)6]+e-+Na+=Na2Fe[Fe(CN)6]
D. 若在无溶解氧的海水中,该电池仍能实现长续航的需求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】UO2与铀氮化物是重要的核燃料,已知:3(NH4)4[UO2(CO3)3]![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
回答下列问题:
(1)基态氮原子价电子排布图为______。
(2)反应所得气态化合物中属于非极性分子的是_______(填化学式)。
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是________(填标号)。
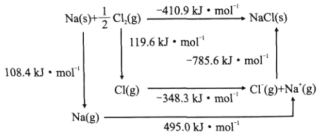
a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)依据VSEPR理论推测CO32-的空间构型为_________。分子中的大丌键可用符号丌![]() 表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大丌键可表示为丌
表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大丌键可表示为丌![]() ),则CO32-中的大丌键应表示为_____
),则CO32-中的大丌键应表示为_____
(5)UO2可用于制备UF4:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]-,反应中断裂的化学键有_______ (填标号)。
2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]-,反应中断裂的化学键有_______ (填标号)。
a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(6)铀氮化物的某两种晶胞如图所示:
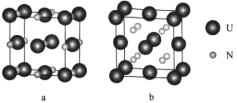
①晶胞a中铀元素的化合价为__________,与U距离相等且最近的U有_______个。
②已知晶胞b的密度为dg/cm3,U原子的半径为r1cm,N原子的半径为为r2cm,设NA为阿伏加德罗常数的值,则该晶胞的空间利用率为___________(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 常温常压下,31 g P4中含P-P键的数目为NA
B. 常温常压下,46 g NO2与92 g N2O4所含的分子数相同
C. 一定条件下,6.4 g铜粉与过量的硫粉充分反应,转移电子数为0.2 NA
D. 标准状况下,将22.4 L Cl2 通入足量NaOH溶液中,转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,两种碳酸盐![]() ,(
,(![]() 分别为Ca2+和Ba2+两种离子)的沉淀溶解平衡曲线如图所示。已知:
分别为Ca2+和Ba2+两种离子)的沉淀溶解平衡曲线如图所示。已知:![]() ,
,![]() 。已知
。已知![]() 比
比![]() 溶解度更大(不考虑阴离子的水解)。下列说法正确的是
溶解度更大(不考虑阴离子的水解)。下列说法正确的是
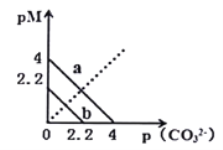
A. 向![]()
![]() 的
的![]() 溶液中加入固体
溶液中加入固体![]() ,当加入
,当加入![]() 固体的质量为
固体的质量为![]() 时,
时,![]() 恰好沉淀完全(离子浓度为
恰好沉淀完全(离子浓度为![]() 时认为沉淀完全;忽略溶液体积变化)
时认为沉淀完全;忽略溶液体积变化)
B. ![]() 的
的![]()
C. 该温度下,向![]() 的饱和溶液中加入
的饱和溶液中加入![]() 溶液,一定能产生沉淀
溶液,一定能产生沉淀
D. 线![]() 表示
表示![]() 的溶解平衡曲线
的溶解平衡曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,22.4LCO2中所含的分子数为NA
B.标准状况下,3.6gH2O所占的体积为4.48L
C.常温常压下,28gN2中所含氮原子数为2NA
D.2.4g金属镁变为镁离子时,失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA、HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是( )

A. a点时,溶液中由水电离的c(OH-)约为1×10-10 mol·L-1
B. 电离平衡常数:Ka(HA)< Ka(HB)
C. b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
D. 向HB溶液中滴加NaOH溶液至pH=7时:c(B-)> c(HB)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下2.24L CO2缓慢通入1L 0.15mol·L-1的NaOH溶液中,气体被充分吸收(溶液体积变化忽略不计),下列关系式不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com