
【题目】将标准状况下2.24L CO2缓慢通入1L 0.15mol·L-1的NaOH溶液中,气体被充分吸收(溶液体积变化忽略不计),下列关系式不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
【答案】C
【解析】
n(CO2)=2.24L/22.4L·mol-1=0.1mol,n(NaOH)=1L×0.15mol·L-1=0.15mol,则发生:2CO2+3OH-=CO32-+HCO3-+H2O,结合CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-解析。
H2CO3+OH-解析。
n(CO2)=2.24L/22.4L·mol-1=0.1mol,n(NaOH)=1L×0.15mol·L-1=0.15mol,则发生:2CO2+3OH-=CO32-+HCO3-+H2O,结合①CO32-+H2O![]() HCO3-+OH-,②HCO3-+H2O
HCO3-+OH-,②HCO3-+H2O![]() H2CO3+OH-,则有:
H2CO3+OH-,则有:
A、溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A正确。
B、n(CO32-)+n(HCO3-)+n(H2CO3)=0.1mol,n(Na+)=0.15mol,根据物料守恒得,2C(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)],故B正确。
C、n(CO32-)+n(HCO3-)+n(H2CO3)=0.1mol,n(Na+)=0.15mol,又存在①CO32-+H2O![]() HCO3-+OH-,②HCO3-+H2O
HCO3-+OH-,②HCO3-+H2O![]() H2CO3+OH-,水解程度①>②且水解程度都较小,则c(HCO3-)>c(CO32-)>c(OH-),则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误。
H2CO3+OH-,水解程度①>②且水解程度都较小,则c(HCO3-)>c(CO32-)>c(OH-),则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误。
D、根据阴阳离子所带电荷相等得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①,根据物料守恒得2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]②,将方程式②-①×2得2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】用两支惰性电极插入50mLAgNO3溶液中,通电电解。当电解液的PH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是:
A. 27mg B. 54mg C. 108mg D. 216mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I是一种抗脑缺血药物,合成路线如下:
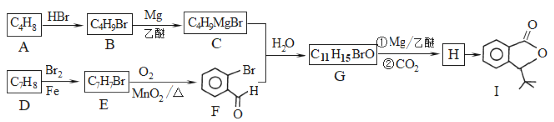
已知:
回答下列问题:
(1)按照系统命名法,A的名称是_____;写出A发生加聚反应的化学方程式:__________。
(2)反应H→I的化学方程式为________;反应E→F的反应类型是______。
(3)写出符合下列条件的G的所有同分异构体的结构简式:________
①遇FeCl3溶液发生显色反应 ②核磁共振氢谱有4组峰
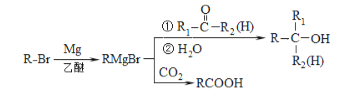
(4)α,α-二甲基苄醇(![]() )是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备α,α-二甲基苄醇的合成路线如下:
)是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备α,α-二甲基苄醇的合成路线如下:

该合成路线中X的结构简式为____,Y的结构简式为________;试剂与条件2为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学原理与应用有非常重要的意义。
(1)锌锰电池(俗称干电池) 是一种一次电池,生活中应用广泛。
①锌锰电池负极上的电极反应式为:______________________________。
②与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是____________________(回答一条即可)。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充电时阴极反应为:________________________________________。
②用铅蓄电池为电源进行电解饱和食盐水实验(石墨棒为阳极,铁为阴极,食盐水500mL,温度为常温),当电路中有0.05mol电子转移时,食盐水的PH为______(假设溶液体积不变,产物无损耗)。
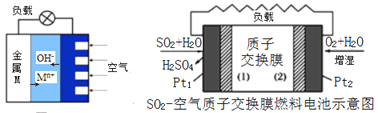
(3)如图是金属(M)-空气电池的工作原理,我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池反应为:___________________________ 。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。Pt2上的电极反应式为:_______________________________________ 。
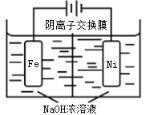
(4)高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,可以用电解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。电解一段时间后,c(OH)降低的区域在_____________(填“阴极室”或“阳极室”);阳极反应为:___________________________。
FeO42+3H2↑,工作原理如图所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。电解一段时间后,c(OH)降低的区域在_____________(填“阴极室”或“阳极室”);阳极反应为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰是重要的合金材料和催化剂,在工农业生产和科技领域有广泛的用途。请回答下列问题:
(1)溶液中的Mn2+可被酸性![]() 溶液氧化为MnO4-,该方法可用于检验Mn2+。
溶液氧化为MnO4-,该方法可用于检验Mn2+。
①检验时的实验现象为_________。
②该反应的离子方程式为___________。
③ ![]() 可看成两分子硫酸偶合所得,若硫酸的结构式为
可看成两分子硫酸偶合所得,若硫酸的结构式为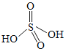 ,则
,则![]() 的结构式为_________。
的结构式为_________。
(2)实验室用含锰废料(主要成分![]() ,含有少量
,含有少量![]() )制备Mn的流程如下:
)制备Mn的流程如下:
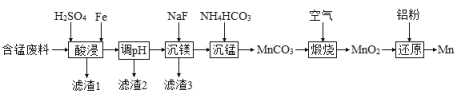
已知:Ⅰ.难溶物的溶度积常数如下表所示:
难溶物 |
|
|
|
|
溶度积常数( | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
Ⅱ.溶液中离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。
①“酸浸”时,![]() 将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
将Fe氧化为Fe3+。该反应的离子方程式为________;该过程中时间和液固比对锰浸出率的影响分别如图1、图2所示:
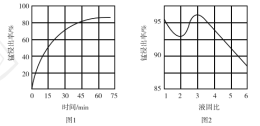
则适宜的浸出时间和液固比分别为___________、___________。
②若“酸浸”后所得滤液中c(Mn2+)=0.18 mol·L-1,则调pH”的范围为___________。
③“煅烧”反应中氧化剂和还原剂的物质的量之比为_______。“还原”时所发生的反应在化学上又叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为______;C中官能团的名称是_______。
(2)③的反应试剂和反应条件分别是_______,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________
(4)反应④的化学方程式为__________
(5)G的相对分子质量为__________。
(6)![]() 是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
①![]() 直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
(7)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为(其他无机试剂任选)_____。
的路线为(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水凝胶材料要求具有较高的含水率,以提高其透氧性能,在生物医学上有广泛应用。由N-乙烯基吡咯烷酮(NVP)和甲基丙烯酸![]() -羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
-羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
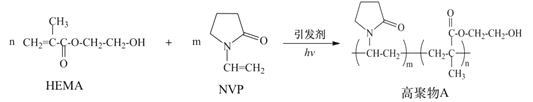
下列说法正确的是
A. NVP具有顺反异构
B. 高聚物A因含有-OH而具有良好的亲水性
C. HEMA和NVP通过缩聚反应生成高聚物A
D. 制备过程中引发剂浓度对含水率影响关系如图,聚合过程中引发剂的浓度越高越好

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
A.用A表示的化学反应速率是0.4mol·L-1·min-1
B.分别用B、C、D表示化学反应速率,其比是3∶2∶1
C.在2min末的反应速率用B表示是0.3mol·L-1·min-1
D.在这2min内B和C两物质的浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜(Cu)、硒(Se)、碲(Te)外,还含有少量稀贵金属,主要物质为Cu、Cu2Se和Cu2Te。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数(%) | 0.04 | 0.76 | 0.83 | 43.47 | 17.34 | 9.23 |
(1)16S、34Se、52Te为同主族元素,其中34Se在元素周期表中的位置______。
其中铜、硒、碲的主要回收流程如下:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:Cu2Te+____H2SO4 ![]() 2CuSO4+____TeO2+____+____H2O
2CuSO4+____TeO2+____+____H2O
(3)SeO2与吸收塔中的H2O反应生成亚硒酸。焙烧产生的SO2气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为______ 。
(4)沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。
① “水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因__________。
②滤液2经过、____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
(5)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着TeO32-浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为___________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com