
| A、离子半径:aW2+>bX+>dZ->CY2- |
| B、b=c+3 |
| C、Z元素的非金属性比Y的强,HZ沸点一定比H2Y的高 |
| D、上述四种元素的最高价氧化物水化物都能与Al(OH)3反应生成盐和水 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、臭氧与氧气是氧元素的两种同素异形体,其物理性质相同 |
| B、打雷时、高压电机和复印机工作时均会产生臭氧 |
| C、臭氧能与Ag、Hg等与氧气不易反应的物质发生化学反应 |
| D、臭氧的密度大于空气,故臭氧主要集中在地面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、和酸反应放出等量的CO2所消耗的酸比Na2CO3少 |
| B、相同温度下溶解度比Na2CO3要大 |
| C、热稳定性比Na2CO3强 |
| D、NaHCO3只能和酸作用不能和碱作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的存在形态只有两种:化合态和游离态 |
| B、同一元素,呈化合态时,其化合价一定比游离态时高 |
| C、有多少种元素,就有多少种物质 |
| D、同一元素在不同的物质中表现的存在形态一定不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、ClO-、S2-、Na+ | ||||
B、H+、I-、N
| ||||
| C、K+、Cl-、ClO-、Na+ | ||||
D、Cu2+、Cl-、N
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向试管中加入相同体积浓度为0.005 mol?L-1的FeCl3溶液和0.01 mol?L-1的KSCN溶液,再加入几滴饱和FeCl3溶液; 证明增大反应物浓度,平衡向正反应方向移动. |
| B、将Cl2通入0.1 mol?L-1KBr溶液中,再加入少量CCl4,振荡; 证明氯、溴的非金属性强弱. |
| C、用饱和Na2CO3溶液可将BaSO4转化为BaCO3; 证明Ksp(BaCO3)>Ksp(BaSO4). |
| D、用pH计测定0.1 mol?L-1醋酸溶液的Ph; 证明醋酸在水溶液中部分电离. |
查看答案和解析>>
科目:高中化学 来源: 题型:
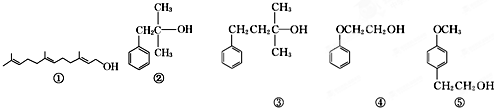
| A、可用酸性KMnO4溶液检验①中是否含有碳碳双键 |
| B、②和③互为同系物,均能催化氧化生成醛 |
| C、④和⑤互为同系物,可用核磁共振氢谱检验 |
| D、等物质的量的上述5种有机物与足量的金属钠反应,消耗钠的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com