
| 1×3+1×1 |
| 4 |
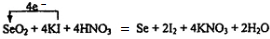 ,
,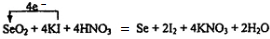 ;
;| 1 |
| 4 |
| 0.13875g |
| 0.1500g |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
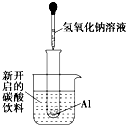 如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块铝片,再用滴管滴加5mL浓NaOH溶液于试管中,试回答下列问题:
如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入几小块铝片,再用滴管滴加5mL浓NaOH溶液于试管中,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T/℃ | NO初始浓度 mol?L-1 | CO初始浓度 mol?L-1 | 催化剂的比表面积 ㎡?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为 (烃基R中不含有叁键).0.1mol A与溶有96g液溴的四氯化碳溶液恰好完全反应,0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为10.6mol.
为 (烃基R中不含有叁键).0.1mol A与溶有96g液溴的四氯化碳溶液恰好完全反应,0.1mol A完全燃烧时生成的CO2和H2O的物质的量之和为10.6mol.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 |
| B、工业上制H2SO4过程中SO2氧化条件一般选择高温、高压、催化剂 |
| C、浓H2SO4有强氧化性,常温下能与Cu发生反应 |
| D、将C12通入冷的消石灰中可制得漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:aW2+>bX+>dZ->CY2- |
| B、b=c+3 |
| C、Z元素的非金属性比Y的强,HZ沸点一定比H2Y的高 |
| D、上述四种元素的最高价氧化物水化物都能与Al(OH)3反应生成盐和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com