
| A、HCO3-、Ba2-、SO42-、H+ |
| B、K+、SiO32-、H+、Cl- |
| C、Fe3+、OH-、NO3-、HCO3- |
| D、Al3+、H+、NO3-、SO42- |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸银 | B、单质碘 |
| C、溴化银 | D、硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
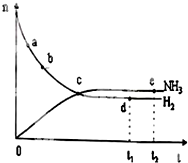 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A、点a的逆反应速率比点b的大 |
| B、点c处反应达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
| D、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食品添加剂一般对人体无害,可任意添加 |
| B、用二氧化硫漂白过的银耳不仅色泽美观,而且营养更丰富 |
| C、在食盐中加入碘酸钾有利于防止甲状腺肿大 |
| D、往婴幼儿奶粉里添加三聚氰胺可以提高奶粉中蛋白质的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com