
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
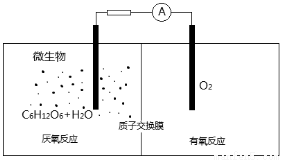
A.负极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.正极反应为:O2 + 4e- +2H 2O=4OH?
2O=4OH?
科目:高中化学 来源:2015-2016学年河北保定一中高二下期末化学试卷(解析版) 题型:选择题
如表各选项中,不能利用置换反应通过Y得到W的一组化合物是
选项化合物 | A | B | C | D |
Y | CuO | H2O | SiO2 | FeCl3 |
W | H2O | Fe3O4 | CO | CuCl2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西西北大学附中高二下期末化学试卷(解析版) 题型:选择题
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )

A. W元素的第一电离能小于Y元素的第一电离能
B. Y、Z的阴离子电子层结构都与R原子的相同
C. p能级未成对电子最多的是Z元素
D. X元素是电负性最大的元素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二下期末化学试卷(解析版) 题型:实验题
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂。实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:


(1)电解时的阳极反应方程式为____________________________________。
(2)除去ClO2中的NH3可选用的试剂为是_____(填标号)
A.水 B.浓硫酸 C.碱石灰 D.饱和食盐水
(3)用右图装置可以测定混合气中ClO2的含量:
I.在锥形瓶中加入足量的碘化钾,用50ml水溶解后,再加入3ml稀硫酸;
II.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
III.将一定量的混合气体通入锥形瓶中吸收;
IV.将玻璃液封装置中的水倒入锥形瓶中;
V.用0.2000mol/L 硫代酸钠标准溶液滴定锥形瓶中的溶 液(I2+2S2O32—===2I—+S4O62—),指示剂显示终点时共用去20.00ml硫代酸钠溶液。在此过程中:
液(I2+2S2O32—===2I—+S4O62—),指示剂显示终点时共用去20.00ml硫代酸钠溶液。在此过程中:
①玻璃液封装置的作用是_________。
② V中加入的指示剂通常为______,滴定至终点的现象是______。
③测定混合气中ClO2的质量为______g。
④用此方法测定混合气中ClO2的质量常常偏高,可能的原因是_____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二下期末化学试卷(解析版) 题型:选择题
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )
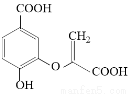
A. 分子中含有3种官能团
B.可与乙醇、乙酸、溴水发生反应,且反应类型相同
C.1mol分枝酸最多可与2molNaHCO3发生反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二下期末化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.用托盘天平准确称取0.4000 g NaCl固体可配成100 mL 0.1000 mol·L-1的NaCl标准溶液
B.有盐桥的原电池和无盐桥的原电池原理相同,因此没必要使用盐桥。
C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H>0,因此该反应不能自发进行
D.电解精炼铜时,阳极泥可用于提取贵重金属。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末文科化学试卷(解析版) 题型:选择题
砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,正确的是
A. 与H2化合的能力:At2>I2
B. 砹在常温下为白色固体
C. AgAt易溶于水
D. 砹难溶于水,易溶于四氯化碳
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期末化学试卷(解析版) 题型:选择题
下列离子方程式的书写正确的是
A.玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O
B.向NaHCO3溶液中加入少量的澄清石灰水,出现白色沉淀:
Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-
C.硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O
D.NaHSO3溶液中投入过氧化钠粉末:4HSO3- +2Na2O2═4SO32- + O2↑ + 4Na++ 2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:填空题
除金、铂等极少数金属外,绝大多数金属元素以化合物形式存在于自然界中,将金属元素从其化合物中还原出来的工业工程称为金属的冶炼。下列材料描述了一些常见金属的冶炼方法。
①工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁。
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气。
③湿法炼铜是工业上常用的一种炼铜的方法。使用铁和硫酸铜溶液反应。
④工业上冶炼银的方法是加热条件下让氧化银分解。
⑤冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰。
⑥相关各物质熔点见下表:
物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
Ⅰ根据上述信息回答下列问题:
(1)影响金属冶炼方法的首要因素是 。
(2)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是 。
(3)写出铝热法冶炼锰的化学方程式 ,一般使用铝热法冶炼的金属具有哪些性质 。
Ⅱ下面是皮江法冶炼镁的工业流程示意图
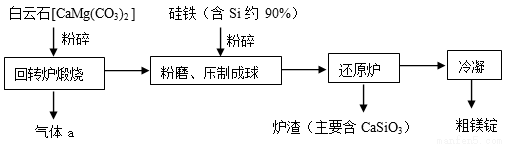
(1)气体a是 。
(2)白云石煅烧前粉碎的目的是 。
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有 、 。
(4)还原炉中抽空气到近似真空的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com