
����Ŀ�������ǻ������������ֺ������绢�����������ǡ��ִ���ҵ��ζ����������ϡ�����ȶ��ģ������������ܽ���Ũ����������VO2+��
(1)��д����������Ũ���ᷴӦ�����ӷ���ʽ:__________________________________��
(2)����NH4VO3ʱ�����ɷ���������V2O5����д���÷�Ӧ�Ļ�ѧ����ʽ:___________��
(3)V2O5�ǽ�ǿ������������������ڵ�Ũ�������ò������������з�Ԫ�ر���ԭΪ��ɫ��VO2+����д���÷�Ӧ�����ӷ���ʽ:______________________________________��
(4)V2O5�������������ǿ�Ӧ���ɷ�����(������ΪVO43-)������ǿ�����ɺ���������(VO2+)���Ρ���д��V2O5�ֱ����ռ���Һ��ϡ���ᷴӦ���ɵ��εĻ�ѧʽ:______��______��
(5)��ҵ���ýӴ���������ʱҪ�õ�V2O5��������SO2�Ĺ����У�450��ʱ����V2O5��VO2֮���ת��:V2O5+SO2=2VO2+SO3��4VO2+O2=2V2O5��˵��V2O5�ڽӴ�������������������������_________��
���𰸡� V+6H++5NO3-=VO2++5NO2��+3H2O(2��) 2NH4VO3![]() V2O5+2NH3��+H2O( V2O5+6H++2Cl-
V2O5+2NH3��+H2O( V2O5+6H++2Cl-![]() 2VO2++Cl2��+3H2O Na3VO4 (VO2)2SO4 �����������
2VO2++Cl2��+3H2O Na3VO4 (VO2)2SO4 �����������
��������������Ҫ����İ������ʽ����д��(1) �����������ܽ���Ũ����������VO2+���ʽ�������Ũ���V+6H++5NO3-=VO2++5NO2��+3H2O��(2)������������NH4VO3ʱ�����ɷ���������V2O5���䷽��ʽΪ��2NH4VO3![]() V2O5+2NH3��+H2O��(3)Ũ������V2O5��Ӧ��������Ԫ�صĻ��ϼ����ߣ���Ԫ�ر���ԭΪ��ɫ��VO2+���䷴Ӧ���ӷ���ʽΪ��V2O5+6H++2Cl-
V2O5+2NH3��+H2O��(3)Ũ������V2O5��Ӧ��������Ԫ�صĻ��ϼ����ߣ���Ԫ�ر���ԭΪ��ɫ��VO2+���䷴Ӧ���ӷ���ʽΪ��V2O5+6H++2Cl-![]() 2VO2++Cl2��+3H2O��(4)V2O5��ǿ�Ӧ����Na3VO4��V 2O5��ǿ������(VO2)2SO4��(5)�ɷ���ʽV2O5+SO2=2VO2+SO3��4VO2+O2=2V2O5��֪��˵��V2O5�ڽӴ�������������������á�
2VO2++Cl2��+3H2O��(4)V2O5��ǿ�Ӧ����Na3VO4��V 2O5��ǿ������(VO2)2SO4��(5)�ɷ���ʽV2O5+SO2=2VO2+SO3��4VO2+O2=2V2O5��֪��˵��V2O5�ڽӴ�������������������á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������������о�����Ҫ�����á�̼ԭ�ӱ����Ļ�ѧ���ʣ�ʹ���ܹ�ͨ����ѧ�����ӳ������Ӷ��γɸ����������ӡ�����˵�������ϵ���������̼Ԫ�صĻ����Ͻ��������ġ�������ʵ����˵��
A. CԪ��������еĵĻ�����
B. CԪ���������������������Ԫ��
C. CԪ���Ǹ��ִ�����к�������Ԫ��
D. CԪ�ر�����Ԫ����Ҫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ���,H2S�Ǽ�NO��CO֮��ĵ�����������ϵ�����źŷ��ӣ������в���������źŴ��ݡ�����Ѫ�ܼ����Ѫѹ�Ĺ��ܡ�����ʱ��H2S��ˮ�еĵ��볣��Ka1=1.3��10-7,Ka2=7.0��10-15����Ҫ��ش���������:
(1)H2S��ˮ�еĶ������볣������ʽKa2=______;0.1mol/LNa2S��Һ������Ũ���ɴ�С��˳��Ϊ__________.
(2)������,��0.1mol/LH2S��Һ��ͨ��HCl�����NaOH����,���c(S2-)����ҺpH�Ĺ�ϵ��ͼ(������Һ����ı仯��H2S�Ļӷ�)��

�ٵ���Һ��c(S2-)=1.4��10-19mol/Lʱ,��Һ��c(OH-)=______,ˮ���������c(H+)=______.
�ڵ�pH=13ʱ,��Һ�е�c(H2S)+c(HS-)=_______.
(3)�ڹ�ҵ��ˮ�����г���H2S��Mn2+ת��ΪMnS��ȥ��������,����0.010mol��L-1 Mn2+��ˮ��ͨ��H2S�Ե��ڷ�ˮ��pH,��c(HS-)=2.0��10-4mol��L-1ʱ,Mn2+��ʼ��������ʱ��ˮ��pH=___��[��֪Ksp(MnS)=1.4��10-15]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��ѧ���Ķ��Ѻ��γ��ǻ�ѧ��Ӧ�������仯����Ҫԭ��
B. ��֪������Ksp[Mg(OH)2]=1.8��10-11����Mg(OH)2��pH=12��NaOH��Һ�е��ܽ��ԼΪ1.044��10-6g
C. ˮ�ܣ����ܡ����������ǿ�������Դ��ú��ʯ�͡���Ȼ���Dz���������Դ
D. �÷�ȩ��֬�Ƴɵ����Ͽɷ����������ڼӹ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������Ҫԭ�����ŷ�SO2�йص��ǣ� ��
A.����ЧӦ
B.�⻯ѧ����
C.�����ն�
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�����ӷ���ʽ��ȷ���ǣ�������
A.��ͭ���缫���CuSO4��Һ��2Cu2++2H2O=2Cu��+O2��+4H+
B.���Ե缫���MgCl2��Һ��2Cl��+2H2O ![]() 2OH��+Cl2��+H2��
2OH��+Cl2��+H2��
C.��ȩ��Һ�м������Ƽ���Cu��OH��2����Һ������CH3CHO+2 Cu��OH��2+OH�� ![]() CH3COO��+Cu2O��+3H2O
CH3COO��+Cu2O��+3H2O
D.��������Һ�еμӹ�����ˮ��Ag++NH3H2O�TAgOH��+NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۶������Ҷ�������PES����һ������ɽ���ľ������������ϱ�Ĥ��ʳƷ��װ��������Ϸ������Ź㷺��Ӧ�ã���ṹ��ʽΪ�� 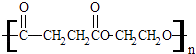 �پ۶������Ҷ�������PES���������ֵ���ͨ����Ӧ���Ӧ���ͣ��Ƶõģ��γɸþۺ�������ֵ������� ��
�پ۶������Ҷ�������PES���������ֵ���ͨ����Ӧ���Ӧ���ͣ��Ƶõģ��γɸþۺ�������ֵ������� ��
�������ֵ����֮��Ҳ�����γ�һ�ְ�Ԫ��״������д���û�״������Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ�������
A.��ˮͨ������SO2��SO2+2NH3H2O�T2NH4++SO32��+H2O
B.��Ba��OH��2��Һ����NaHSO4��Һ����SO42��ǡ����ȫ������Ba2++SO42��+2OH��+2H+�TBaSO4��+2H20
C.�������Һ�еμӹ���NaOH��Һ��H++OH���TH2O
D.������Cu��OH��2����Һ�м�����ȩ��Һ�����ȣ�CH3CHO+2Cu��OH��2+OH�� ![]() CH3COO��+Cu2O��+3H2O
CH3COO��+Cu2O��+3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���H�Ǻϳ��������Ƽ�ҩ��ù������м��壬��������·���ϳɵõ��� 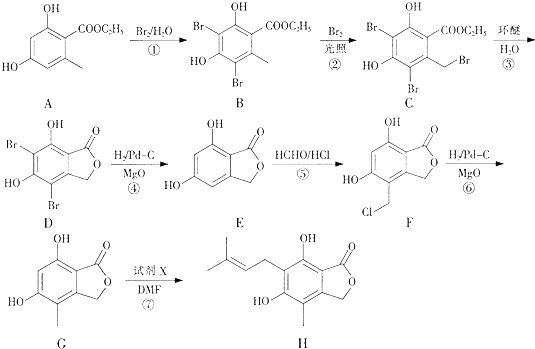
��1���л���A�еĺ��������ŵ�����Ϊ ��
��2����Cת��ΪD�ķ�Ӧ����Ϊ ��
��3����Ӧ�߳��˵õ��л���H��õ�HBr���Լ�X�Ľṹ��ʽΪ ��
��4������ݿɵõ�����Ʒ�л���J���л���J���л���F��Ϊͬ���칹�壬д���л���J�Ľṹ��ʽ������дһ�֣���
��5��E��һ��ͬ���칹���������������� ���Է���������Ӧ�����ܹ���NaHCO3��Ӧ����CO2��
���Ƿ����廯����Һ˴Ź�������ͼ��ʾ��������4�ֲ�ͬ��ѧ�������⣮
д����ͬ���칹��Ľṹ��ʽ�� ��
��6����֪��ֱ���뱽��������±��ԭ��������NaOHˮ��Һ����ȡ����Ӧ����������֪ʶ����������Ϣ��д���� ![]() HCHOΪԭ���Ʊ�
HCHOΪԭ���Ʊ� ![]() �ϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£� CH3CH2OH
�ϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£� CH3CH2OH ![]() H2C=C2H
H2C=C2H ![]()
![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com