
【题目】向某无色透明的未知溶液中加入BaCl2溶液,生成白色沉淀,再加入稀硝酸,沉淀无变化。则未知溶液中
A.一定存在Ag+ B.一定存在SO42-
C.一定存在Ag+和SO42- D.Ag+和SO42-至少存在一种
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
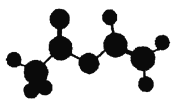
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物既能发生水解反应,又能发生氧化反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各变化中属于原电池反应的是( )。
A.在空气中,金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,锌被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓HNO3比稀HNO3更易氧化金属铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:
CO(g)+2H2(g)=CH3OH(l) △H=?
(1)已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H = kJ·mol-1
(2)若装置为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OH) /mol·L-1 | |
0min | 0.8 | 1.6 | 0 |
2min | 0.6 | y | 0.2 |
4min | 0.3 | 0.6 | 0.5 |
6min | 0.3 | 0.6 | 0.5 |
反应从2min到4min之间,H2的平均反应速率为________ mol·Lˉ1·minˉ1。
反应在第2min时改变了反应条件,改变的条件可能是 (填字母序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.减小CH3OH(g)的浓度
(3)若在容积可变的密闭容器中充入1 mol CO(g)和2 molH2 (g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。
(4)一定温度下,在容积固定的密闭容器中充入一定量的H2和CO,在t1时达到平衡。t2时将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时达到新的平衡状态,之后不再改变条件。请在右图中补画出从t2到t4正反应速率随时间的变化曲线。
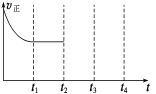
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是
A.在熔融电解质中,O2-由负极移向正极
B.通入空气的一极是正极,电极反应为:O2+2H2O+4e-=4OH-
C.通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
A.Na2O2和CO2 B.Na和O2 C.NaOH 和CO2 D.C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于可逆反应的是( )
A. Fe + CuCl2﹦FeCl2 + Cu B. 2 Na + 2H2O = 2NaOH + H2↑
C. 2H2 + O2![]() 2H2O D. H2+I2
2H2O D. H2+I2 ![]() 2HI
2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯水,升温,c(H+)(),KW(),溶液呈()性
A. 变大 变小 酸性 B. 变大 变大 中性 C. 变小 变大 碱性 D. 变小 变小 中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯( )在有机合成中占有重要的地位,有着广泛的用途。
)在有机合成中占有重要的地位,有着广泛的用途。
已知:
①![]() ΔH1=-54kJ·mol-1。
ΔH1=-54kJ·mol-1。
②![]() ΔH2=-121kJ·mol-1。
ΔH2=-121kJ·mol-1。
③H2(g)+Cl2(g)=2HCl(g) ΔH3=-185kJ·mol-1。
④相关化学键的键能数据如表所示。
化学键 | C—H | C—C | C=C | C—Cl | H—Cl |
键能/(kJ·mol-1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)根据化学反应原理,缩小容器容积对反应②的影响为________。
(2)根据反应①和表中数据计算,x=________。
(3)![]()
①ΔH4=________。
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为________(填“A”或“B”),理由为________。

④T1℃时,该反应的平衡常数K=________。该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol![]() (g)、2molCl2(g)、1mol
(g)、2molCl2(g)、1mol![]() (g)、2molHCl(g),则开始时,v正________(填“>”“<”或“=”)v逆。
(g)、2molHCl(g),则开始时,v正________(填“>”“<”或“=”)v逆。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com