
【题目】甲醇是21世纪应用最广泛的清洁燃料之一,通过以下反应可以制备甲醇:
CO(g)+2H2(g)=CH3OH(l) △H=?
(1)已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0kJ·mol-1
则制备甲醇反应的△H = kJ·mol-1
(2)若装置为容积固定的密闭容器,不同时间段各物质的浓度如下表:
c(CO) /mol·L-1 | c(H2) /mol·L-1 | c(CH3OH) /mol·L-1 | |
0min | 0.8 | 1.6 | 0 |
2min | 0.6 | y | 0.2 |
4min | 0.3 | 0.6 | 0.5 |
6min | 0.3 | 0.6 | 0.5 |
反应从2min到4min之间,H2的平均反应速率为________ mol·Lˉ1·minˉ1。
反应在第2min时改变了反应条件,改变的条件可能是 (填字母序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度 D.减小CH3OH(g)的浓度
(3)若在容积可变的密闭容器中充入1 mol CO(g)和2 molH2 (g)生成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图所示。当达到平衡状态A 时,容器的体积为2 L,此时该反应的平衡常数为 ,若达到平衡状态B 时,则容器的体积V(B)= L。
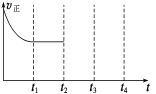
(4)一定温度下,在容积固定的密闭容器中充入一定量的H2和CO,在t1时达到平衡。t2时将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时达到新的平衡状态,之后不再改变条件。请在右图中补画出从t2到t4正反应速率随时间的变化曲线。
【答案】(1)-128.1;(2)0.3,A;
(3)4,14;(4)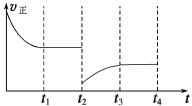 。
。
【解析】
试题分析:(1)①2H2(g)+O2(g)=2H2O(l),②2CO(g)+O2(g)=2CO2(g) ,③2CH3OH (l) +3O2(g)=2CO2(g)+4H2O(l),(①×2+②-③)/2,得出:CO(g) + 2H2(g) = CH3OH (l) △H=(-571.6×2-566.0+1453)/2kJ·mol-1=-128.1kJ·mol-1;(2)根据化学反应速率表达式,v(CO)=(0.6-0.3)/2mol/(L·min)=0.15mol/(L·min),根据化学反应速率之比等于化学计量数之比,v(H2)=2v(CO)=0.15×2mol/(L·min)=0.3mol/(L·min),0~2min是v(CO)=(08-0.6)/2mol/(L·min)=0.1mol/(L·min),2min时反应速率加快,根据反应方程式,求出y=1.2,A、使用催化剂反应速率加快,故正确;B、降低温度,化学反应速率降低,故错误;C、增加H2的浓度,反应速率虽然增加,根据上述分析,以及表格数据,氢气的浓度没有增加,故错误;D、减小甲醇的浓度,对正反应速率没有影响,故错误;
(3)CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始: 1 2 0
变化: 0.5 1 0.5
平衡: 0.5 1 0.5,
根据平衡常数的表达式,K=c(CH3OH)/[c(CO)×c2(H2)]=4,
开始时容器的体积为3:(0.5+1+0.5)=V:2,解得V=3,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始: 1 2 0
变化: 0.8 1.6 0.8
平衡: 0.2 0.4 0.8,
根据体积之比等于物质的量之比,3:(0.2+0.4+0.8)=3:V,解得V=1.4;(4)t2时容积扩大到原来的2倍,组分浓度减小,根据勒夏特列原理,平衡向逆反应方向移动,v正增大,t3时达到平衡,即图像是: 。
。


科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法。下列分类合理的是( )
A. CaCO3和CaO都属于盐 B. H2SO4和HCl都属于酸
C. NaOH和Na2CO3都属于碱 D. CuO和CuCO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是
A.Mg和Al都可以用电解法冶炼得到
B.Na2O和Na2O2与CO2反应产物相同
C.MgO和Al2O3均只能与酸反应,不能与碱反应
D.Mg和Fe在一定条件下与水反应都生成H2和对应的碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与人类生活密切相关。下列物品与对应的材料相匹配的是
A. 光导纤维——硅酸盐材料 B. 透明饮料瓶——合金材料
C. 纯棉织物——合成纤维材料 D. 橡胶轮胎——有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种抗酸药X(仅含五种短周期元素)的组成和性质,设计并完成了如下实验:
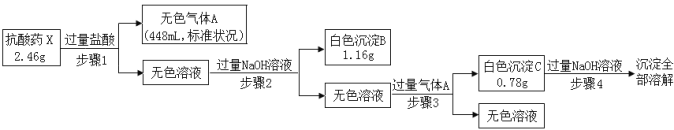
请回答下列问题:
(1)白色沉淀B的化学式是 。
(2)步骤3中生成沉淀C的离子方程式为 。
(3)X的化学式为 。
(4)该抗酸药不适合胃溃疡重症患者使用,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃若溶液中由水电离产生的C(OH-)=1×10-14 mol·L-1,满足此条件的溶液是()
A. 酸性 B. 碱性 C. 酸性或碱性 D. 中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某无色透明的未知溶液中加入BaCl2溶液,生成白色沉淀,再加入稀硝酸,沉淀无变化。则未知溶液中
A.一定存在Ag+ B.一定存在SO42-
C.一定存在Ag+和SO42- D.Ag+和SO42-至少存在一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com