
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
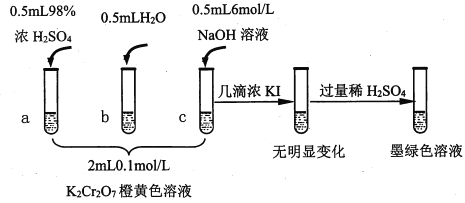
已知:Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____(“是”或“否”),理由是_________________________________。
(3)对比试管a、b、c的实验现象,得到的结论是________________。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______;写出此过程中氧化还原反应的离子方程式________________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
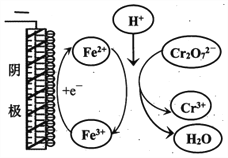
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。
【答案】 溶液变黄色 否 Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果 碱性条件下,+6价铬主要以CrO42-存在;酸性条件下,主要以Cr2O72-存在 碱性条件下,CrO42-不能氧化I-;酸性条件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性强于CrO42-) 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O 阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率
2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果 碱性条件下,+6价铬主要以CrO42-存在;酸性条件下,主要以Cr2O72-存在 碱性条件下,CrO42-不能氧化I-;酸性条件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性强于CrO42-) 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O 阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率
【解析】(1)针对Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+反应来说,试管c中加入碱,消耗了H+,平衡右移,溶液变黄色;正确答案:溶液变黄色。
2CrO42-(黄色)+2H+反应来说,试管c中加入碱,消耗了H+,平衡右移,溶液变黄色;正确答案:溶液变黄色。
(2)Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果;正确答案:否;Cr2O72-(橙色)+H2O
2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果;正确答案:否;Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果。
2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果。
(3)对比试管a、b、c的实验现象,得到的结论在酸碱性不同的情况下,溶液中主要存在的离子不同;碱性条件下,+6价铬主要以CrO42-存在;酸性条件下,主要以Cr2O72-存在;正确答案:碱性条件下,+6价铬主要以CrO42-存在;酸性条件下,主要以Cr2O72-存在。
(4)从实验现象分析可知:碱性条件下,CrO42-不能氧化I-,所以无明显变化;酸性条件下,Cr2O72-能氧化I-,本身被还原为Cr3+,变为墨绿色溶液;此过程中氧化还原反应的离子方程式:. 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O ;正确答案:碱性条件下,CrO42-不能氧化I-;酸性条件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性强于CrO42-);6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O。
(5)①实验ⅱ中Cr2O72-在阴极被还原为Cr3+,电极反应式Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O;正确答案:Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O。
②根据图示分析可知:阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率;正确答案:阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率。


科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,下列做法有利于环境保护和可持续发展的是( )
A.大量生产一次性超薄塑料袋方便日常生活
B.对所有垃圾以直接露天焚烧的方式进行处理
C.加大农药和化肥的生产和使用量,以提高粮食的产量
D.推行绿色设计、绿色工艺、开发绿色产品,从源头上消除污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列电离方程式判断,下列分组正确的是( )
①H2SO4===2H++![]() 、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2
、②Ba(OH)2===Ba2++2OH-、③KAl(SO4)2===K++Al3++2![]() 、④NaHSO4===Na++H++
、④NaHSO4===Na++H++![]()
A. 属于酸的是①④ B. 属于碱的是②
C. 属于盐的只有③ D. 属于盐的只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知100 kPa、298.15 K时氢氟酸的电离过程HF(aq)H+(aq)+F-(aq) ΔH=-12.5kJ·mol-1,ΔS=-102.5 J·mol-1·K-1,试判断该过程的自发性( )
A. 可自发进行 B. 不能自发进行 C. 达到平衡 D. 不能判定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A. 右边CO与CO2分子数之比为3:1
B. 右侧CO的质量为14g
C. 右侧气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为6: 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是

A. M点溶液中水的电离程度比原溶液大
B. 在M点时,n(H+)-n(OH-)=(0.005-a)mol
C. 随着NaOH溶液的滴加,![]() 不断增大
不断增大
D. 当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于取代反应的是
A. ![]() + HO-NO2
+ HO-NO2 ![]()
![]()
B. ClCH2CH=CH2 + NaOH![]() HOCH2CH=CH2 + NaCl
HOCH2CH=CH2 + NaCl
C. 2 CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
D. BrCH2CH3 + NaOH![]() CH2 = CH2 ↑+ NaBr +H2O
CH2 = CH2 ↑+ NaBr +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
A.正极附近的SO42―离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com