
【题目】用石墨电极电解饱和食盐水的原理示意图如图所示。下列说法正确的是

A.M 为负极B.通电使氯化钠发生电离
C.电解一段时间后,阴极区 pH 升高D.c 出口收集到的物质是氢气
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是:

A. 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C. 图3表示H2与O2发生反应过程中的能量变化,则氢气的燃烧热为241.8kJ·mo1ˉ1
D. 图4表示用水稀释等体积且pH相同的盐酸和醋酸,溶液导电性:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属腐蚀与防护的说法不正确的是

A.图①,放置于干燥空气中的铁钉不易生锈
B.图②,若断开电源,钢闸门将发生析氢腐蚀
C.图②,若将钢闸门与电源的负极相连,可防止钢闸门腐蚀
D.图③,若金属M 比 Fe 活泼,可防止输水管腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
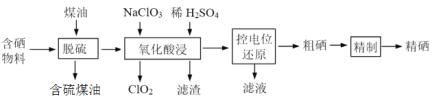
回答下列问题:
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。

(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。

①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(Na2S)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为___________,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO![]() N2+3H2O+3Cu,用下图所示装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C 中的固体是氧化铜。
N2+3H2O+3Cu,用下图所示装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C 中的固体是氧化铜。

回答下列问题:
(1)A中发生反应的化学方程式是_____。
(2)B中加入的物质是_____。
(3)实验时在C中观察到的现象是_____,该反应中氨的作用是_____(填氧化剂或还原剂)。
(4)检验实验后试管D中物质的方法和现象是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔在不同条件下可以转化成许多化合物,如图,下列叙述错误的是( )
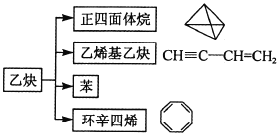
A. 正四面体烷的一氯代物及二氯代物均只有1种
B. 乙炔生成乙烯基乙炔是加成反应
C. ![]() 与环辛四烯(C8H8)互为同分异构体
与环辛四烯(C8H8)互为同分异构体
D. 等质量的苯与乙烯基乙炔完全燃烧时的耗氧量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:
2Cl2(g)+2H2O(g)△H= -120kJ/mol 该反应分两步进行,其基本原理如下图所示:

过程 I 的反应为, 2HCl(g)+CuO(s) ![]() CuCl2(s)+H2O(g)△H= -132kJ/mol
CuCl2(s)+H2O(g)△H= -132kJ/mol
(1)该原理中起到催化剂作用物质的化学式为_______________________;
(2)过程 II 反应的热化学方程式为____________________;
(3)压强为p1时,地康法中HCl 的平衡转化率aHCl 随温度变化曲线如图。

①比较 a、b 两点的平衡常数大小 K(a)=_______________K(b)(填“>”“<”或“=”),解释原因为________________;
②c 点表示投料不变, 350℃、压强为p2时,地康法中HCl 的平衡转化率,则p2_________________p1(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是生产钛白的副产品,价格低,以硫酸亚铁为原料制备高效净水剂高铁酸钾(K2FeO4)可大大降低成本。其生产工艺如下:

已知:NaNO2是在空气中将Fe2+氧化为铁黄(FeOOH)的催化剂;铁黄微溶于酸。
请回答下列问题:
(1)铁黄(FeOOH)中铁元素的化合价是________。写出反应①生成铁黄(FeOOH)的离子方程式:____________________________,在通入O2“氧化”FeSO4的过程中,溶液的pH________(填“增大”“减小”或“不变”)
(2)写出反应③的化学方程式:___________________________________________。
(3)K2FeO4可作为新型多功能水处理剂的原因是_____________________________。
(4)该工艺每消耗标准状况下112LCl2理论上得到________gK2FeO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5 mol![]() 的四种溶液:
的四种溶液:
①Na2CO3;②NaHCO3;③HCl;④NH3![]() H2O。
H2O。
(1)上述溶液中,可发生水解的是_____(填序号)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为_______。
(3)向溶液④中加入少量氯化铵固体,此时![]() 的值_____(填“增大”“减小”或“不变”),c(OH-)变____(填“变大”“变小”或“不变”)
的值_____(填“增大”“减小”或“不变”),c(OH-)变____(填“变大”“变小”或“不变”)
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积____④的体积(填“大于”“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是___。
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com