
【题目】利用天然气合成氨的工艺流程示意图如下:
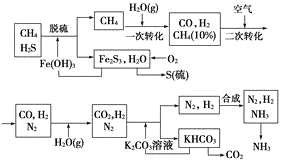
依据上述流程,完成下列填空:
(1)nmol CH4经一次转化后产生CO 0.9nmol,产生H2________mol(用含n的代数式表示)。
(2)K2CO3溶液和CO2反应在加压条件下进行,加压的理论依据是________(填字母代号)。
a.相似相溶原理 b.平衡移动原理 c.酸碱中和原理
(3)由KHCO3分解得到的CO2可以用于________(写出CO2的一种重要用途)。
(4)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3溶液循环,三是________循环。
科目:高中化学 来源: 题型:
【题目】废弃的锌猛干电池对环境污染很大,工业上可用如下工艺回收正极材料中的金属(部分条件未给出):
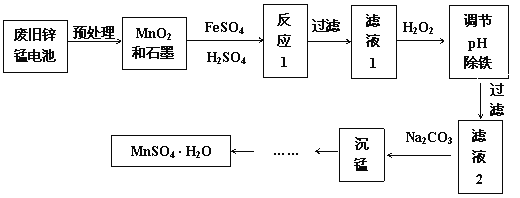
(1)MnO(OH)中Mn的化合价为__;实验室保存FeSO4溶液时为防止被氧化需加入__;实验室保存Fe2(SO4)3溶液时为抑制其水解应当加入__。
(2)加入H2O2的目的是将Fe2+氧化成Fe3+,则用离子方程式表示为___。
(3)该工艺流程中多次用到过滤,实验室中过滤所需要的玻璃仪器除烧杯外还有__。
(4)已知:25℃时,已知Ksp[Fe(OH)3]=1×10-38,当Fe3+浓度为1×10-5mol·L-1时,认为Fe3+沉淀完全,滤液1中加入NaOH溶液至pH=__时Fe3+沉淀完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g) ![]() CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
A.v生成(CH3OH)=v消耗(CO)B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变D.CO、H2、CH3OH的浓度比为1:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为______________、______________。
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效。请你说明其中的化学原理:________________________。
(4)合成氨是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作?______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
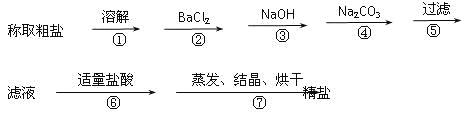
(1)判断BaCl2已过量的方法是_________________________。
(2)第④步中,相关的离子方程式是___________;__________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________。
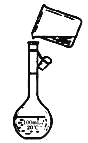
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。

(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。


(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com