
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。

(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。


(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。

【答案】3 氧化剂 MnCO3+H2SO4== MnSO4+CO2↑+H2O > > 温度升高后催化剂失去活性 a 2NO(g)===1/2N2(g)+NO2(g) ΔH=(a-b) kJ·mol-1 N2O 因常温下有2NO2![]() N2O4会导致一定的分析误差
N2O4会导致一定的分析误差
【解析】
本题主要考察了氧化还原反应原理,热反应方程式书写,催化剂性质和化学平衡常数与转化率性质。
(1)由题可知,SO2的吸收率在pH=3时效果最佳;软锰矿(MnO2)吸收SO2制取硫酸锰MnO2,二氧化硫发生氧化反应,故MnO2所起的作用是氧化剂,菱锰矿与硫酸反应,确保pH的稳定,该反应的化学方程式为. MnCO3+H2SO4== MnSO4+CO2↑+H2O;
(2)由图可知,温度升高,CO转化率减小,反应逆向移动,故a温度低于c,K(a)>K(c);可逆反应达到平衡时,转化率最大,故图中b、c点到达平衡,在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率大于α型;反应过程存在催化剂,故e点转化率出现突变的原因可能是温度升高后催化剂失去活性;
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅰ的活化能小于反应Ⅱ的活化能,且0>a>b则示意图正确的是a;
(4)根据盖斯定律,反应①-反应②:2NO(g)===1/2N2(g)+NO2(g) ΔH=(a-b) kJ·mol-1;
(5)模拟尾气中NO的物质的量是0.025mol,而图中参与反应生成的X和Y的NO的物质的量是0.025mol×(8%+16%)=0.006mol,模拟尾气中的氧气物质的量是0.5mol,测得排出的气体中含有0.45mol的氧气,说明实际参与反应的氧气的物质的量为0.05mol,同时测得0.0525mol二氧化碳。根据氧守恒可知,N2O的物质的量是0.05×2+0.06-0.0525×2=0.001mol,根据氮守恒可知,N2的物质的量是0.003-0.001=0.002mol,所以16%对应的是氮气,8%对应的是N2O,故Y是N2O;
(6)实验过程中不采用NO2的模拟NOx原因是存在双聚平衡2NO2![]() N2O4,所以无纯的二氧化氮。
N2O4,所以无纯的二氧化氮。


科目:高中化学 来源: 题型:
【题目】某烧杯中盛有含0.2 mol NH4Al(SO4)2的溶液,向其中缓缓加入4 mol·L-1的NaOH溶液200 mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
A. Al3+和Al(OH)3 B. AlO2— C. AlO2—和Al(OH)3 D. Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多数是离子反应,根据要求回答问题
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性.试用离子方程式表示:①盐碱地产生碱性的原因________、_________;
②Na2CO3溶液中离子浓度大小顺序为__________________________________________;
(2)常温下,等物质的量浓度的①氨水;②NH4HSO4;③NH4Cl;④(NH4)2CO3;⑤(NH4)2SO4溶液中,c(NH4+)由大到小的顺序为 > > > > (填序号).__________
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,水电离出来的c(OH-)=____________.
(4)常温下,将amol/L的醋酸与0.01mol/L的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显 _________(填“酸”“碱”“中”)性,用含a的代数式表示CH3COOH的电离平衡常数Ka= ________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a g Fe、Mg合金溶解在一定量的稀硝酸中,当合金完全溶解后,收集到标准状况下的NO气体b L(设HNO3的还原产物只有NO)。再向反应后的溶液中加入足量NaOH溶液,得到沉淀物。若用守恒法求沉淀的质量,用到的守恒关系依次是
A. 质量守恒、电子守恒、电荷守恒 B. 电子守恒、质量守恒、电荷守恒
C. 电子守恒、电荷守恒、质量守恒 D. 电荷守恒、质量守恒、电子守恒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
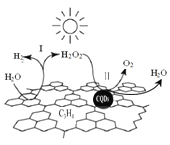
A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) = C(g) ΔH,分两步进行:①A(g)+B(g) = X(g)ΔH1 (慢)②X(g) = C(g) ΔH2(快)反应过程中能量变化如下图所示,下列说法正确的是

A.ΔH1+ ΔH2=ΔH >0B.E2表示反应C(g) =X (g)的活化能
C.E1是反应①的反应热D.整个反应的速率快慢由反应②决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中,充入一定量的H2和I2(g)发生反应:I2(g)+H2(g)![]() 2HI(g) ΔH<0。t2时刻开始只改变一个条件,反应速率与反应进程的曲线关系如图所示。下列说法错误的是
2HI(g) ΔH<0。t2时刻开始只改变一个条件,反应速率与反应进程的曲线关系如图所示。下列说法错误的是
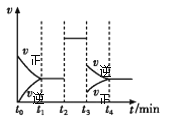
A.t0—t2时段,H2的浓度不变即体系达到平衡
B.t2时,改变的条件只有加入催化剂才能实现
C.在t4所处的平衡体系中,再加入H2,I2(g)的转化率增大
D.HI的体积分数最高的时段是t1—t2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,![]() 是继
是继![]() 、
、![]() 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是__________(填标号)。
A. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B. 氢硫酸的导电能力低于相同浓度的亚硫酸
C. ![]() 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的![]() 分别为
分别为![]() 和
和![]()
D. 氢硫酸的还原性强于亚硫酸
(2)![]() 与
与![]() 在高温下发生反应:H2S(g)+CO2(g)
在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.1mol
COS(g)+H2O(g)。在610K时,将0.1mol![]() 与
与![]()
![]() 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①![]() 的平衡转化率
的平衡转化率![]() ________%,反应平衡常数
________%,反应平衡常数![]() ___________________。
___________________。
②在620K重复实验,平衡后水的物质的量分数为0.03,![]() 的转化率
的转化率![]() ______
______![]() ,该反应的
,该反应的![]() ______0。(填“
______0。(填“![]() ”“
”“![]() ”或“
”或“![]() ”)
”)
③向反应器中再分别充入下列气体,能使![]() 转化率增大的是______(填标号)。
转化率增大的是______(填标号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是

A. 该反应是吸热反应
B. 使用催化剂后反应热减小
C. 热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D. 曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com