
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
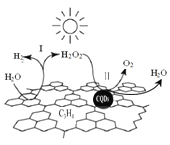
A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】(1)25℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列为___________(填序数)。
(2)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显___________(填“酸”碱”或“中)性;用含a的代数式表示NH3·H2O的电离常数Kb=___________。
(3)一定温度下,向氨水中通入CO2,得到(NH4)2CO3、NH4HCO3等物质,溶液中各种微粒的物质的量分数与pH的关系如图所示。随着CO2的通入,溶液中c(OH-)/c(NH3·H2O)将___________(填“增大”“减小”或“不变”)。pH=9时,溶液中c(NH4+)+c(H+)=___________。

(4)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂,常用于葡萄酒、果脯等食品中。在测定某葡萄酒中Na2S2O5残留量时,取25.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗5.00mL。该滴定反应的离子方程式为___________;葡萄酒中的Na2S2O5的使用量是以SO2来计算的,则该样品中Na2S2O5的残留量为___________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠保存不当容易变质,某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。

上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出以下装置发生反应的化学方程式:
装置A:___________________________。
装置B:___________________________。
装置C:____________________________。
(2)NaOH溶液的作用是_________________________。
(3)为准确读出氧气的体积需以下操作,正确的顺序为_________。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
读出量筒内水的体积后,折算成标准状况氧气的体积为1.12L,则样品中过氧化钠的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO混合气体共8mol,通入足量Na2O2中,并且用电火花持续引爆,充分反应后,剩余气体1mol,则固体增重为多少克?( )
A.56gB.168gC.224gD.196g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中 加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1))中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )

A. 2NO2![]() N2O4是放热反应
N2O4是放热反应
B. NH4Cl溶于水时放出热量
C. 烧瓶(1)中平衡混合气的平均相对分子质量增大
D. 烧瓶(3)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________.
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________(填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
该样品中亚硝酸钠的质量分数为_________.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为_______
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是_____。
(3)过渡金属可形成许多羧基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、_______等(任写一个)。
②CO作配体时,配位原子是C而不是O,其原因是________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A [V(H2O)6]2+ B [V(CN)6]4- C [V(CO)6]- D [V(O2)4]3-
②化合物 的熔点为138℃,其晶体类型为________。
的熔点为138℃,其晶体类型为________。
(5)VCl2(熔点1027℃)和VBr2(熔点827℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是_________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为________(用含a、c、r+和r-的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将少量饱和氯化铁溶液滴入沸水中,继续煮沸,可制得Fe(OH)3胶体,反应的方程式为:FeCl3 + 3H2O ![]() Fe(OH)3(胶体) + 3HCl
Fe(OH)3(胶体) + 3HCl
(1)当溶液呈________时,停止加热,即制得Fe(OH)3胶体。
(2)氢氧化铁胶体与氢氧化铁沉淀的本质区别是____________________。
(3)下列叙述错误的是________。
A.雾属于胶体,能产生丁达尔效应
B.从颜色上无法区别FeCl3溶液和Fe(OH)3胶体
C.明矾可以用于净水,净水原理和胶体有关
D.用盐卤点豆腐与胶体性质有关
Ⅱ.有A、B、C、D四种可溶性盐,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别是NO3-、SO42-、Cl-、CO32-中的一种(离子在物质中不重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。请回答下列问题:
(4)A的化学式为____________,B的化学式为____________。
(5)写出D与足量CH3COOH溶液反应的离子方程式_____________________________。
(6)写出A溶液中阴离子的检验方法______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com