
【题目】(1)25℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列为___________(填序数)。
(2)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显___________(填“酸”碱”或“中)性;用含a的代数式表示NH3·H2O的电离常数Kb=___________。
(3)一定温度下,向氨水中通入CO2,得到(NH4)2CO3、NH4HCO3等物质,溶液中各种微粒的物质的量分数与pH的关系如图所示。随着CO2的通入,溶液中c(OH-)/c(NH3·H2O)将___________(填“增大”“减小”或“不变”)。pH=9时,溶液中c(NH4+)+c(H+)=___________。

(4)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂,常用于葡萄酒、果脯等食品中。在测定某葡萄酒中Na2S2O5残留量时,取25.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗5.00mL。该滴定反应的离子方程式为___________;葡萄酒中的Na2S2O5的使用量是以SO2来计算的,则该样品中Na2S2O5的残留量为___________g·L-1。
【答案】④>①>②>③ 中 ![]() 减小 2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) S2O52-+2I2+3H2O===2SO42-+4I-+6H+ 0.128
减小 2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) S2O52-+2I2+3H2O===2SO42-+4I-+6H+ 0.128
【解析】
(1)根据根据影响水电离的因素进行判断;(2)根据电荷守恒进行判断;(3)根据电子守恒进行解答。
(1)根据影响水电离的因素可知:②NaOH、③H2SO4 抑制水的电离,且相同物质的量浓度的③H2SO4 抑制程度更大;④(NH4)2SO4能发生水解,促进水的电离;①NaCl对水的电离无影响,所以25℃时,相同物质的量浓度的溶液水的电离程度按由大到小顺序排列为④>①>②>③;答案:④>①>②>③;
(2)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),根据电荷守恒,c(H+)+c(NH4+)=c(Cl-)+ c(OH-)所以c(H+)=c(OH),则溶液显中性; 因为平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,因为溶液呈中性,所以c(H+)=c(OH)=10-7mol/L,NH3H2O的电离常数Kb= c(OH-).c(NH4+)/c((NH3.H2O)=107×5×103/(0.5a5×103)=109/(a0.01);答案:![]()
(3)c(OH-)/c((NH3.H2O)= c(OH-)×c(NH4+)/[c((NH3.H2O)×c(NH4+)]=Kb/c(NH4+),Kb不变,c(NH4+)不断增大,比值不断减小;根据电荷守恒,pH=9时,溶液中存在电荷守恒c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-);答案:减小; 2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-);
(4) I2作氧化剂,1molI2参与反应得到2mol电子,S2052-为还原剂,1molS2052-参与反应,硫元素失去4mol电子,根据原子守恒配平方程式: S2052-+212+3H20=2SO42-+4I-+6H+,计算祥品中S2052-的残留量时以SO2计算,n(I2)=n(SO2)=0.01000mol.L1x0.01L=0.0001mol,m(S02)=0.0064g,则该样品中Na2S2O5的残留量为0.0064g/0.05L =0.128g.L-1。答案:0.128。


科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
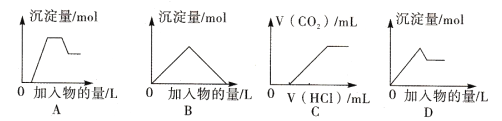
A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有![]() ,常用的方法是( )
,常用的方法是( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不落于水的白色沉淀生成
C.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不落于水的白色沉淀生成
D.取样,滴加稀盐酸,无明显现象,再滴加BaCl2落液,看是否有不溶于水的白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某地粉煤灰中镓含量丰富,其主要成分以Ga2O3的形式存在,除此之外还含有A12O3、Fe3O4、SiO2等杂质。已知从粉煤灰中回收镓的艺流程如图甲所示。

信息:(i)转型液中镓以GaO2-的形式存在;
(ii)Ksp[Ga(OH3)]=1.4×10-34,Ksp[Fe(OH)3]=2.7×10-39,Ksp[Fe(OH)2]=4.87×10-17。
回答下列问题:
(1)滤渣A中一定含有的成分是___________。
(2)“氧化”过程中加入H2O2的目的是___________,该过程中发生反应的离子方程式为___________。
(3)洗脱液中还有少量的Fe3+、Ga3+,其中Ga3+浓度为1.4×10-4mol/L,列式计算当Fe3+恰好沉淀完全时[c(Fe3+)≤1.0×10-5mol/L],G a3+是否开始沉淀___________。
(4)流程图中两次调节pH的目的分别是___________。
(5)电解法可以提纯粗镓,具体原理如图乙所示①粗镓与电源___________极相连(填“正”或“负”)。②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用光伏电池提供电能处理废水中的污染物(有机酸阴离子用R-表示),并回收有机酸HR,装置如图所示。下列说法错误的是
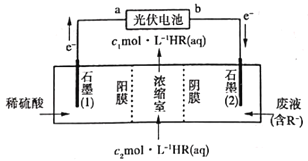
A.在光伏电池中a极为正极B.石墨(2)极附近溶液的pH降低
C.HR溶液:c2<c1D.若两极共收集3mol气体,则理论上转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,请回答下列问题:
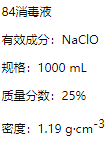
(1)该“84消毒液”的物质的量浓度约为________molL-1。(保留2位有效数字)
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母).
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
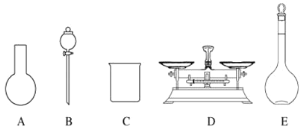
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制200mL 2.3 molL-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要量取浓硫酸的体积为________mL;(保留2位有效数字)
②定容时向容量瓶中注入蒸馏水,液面离刻度线下________时,改用胶头滴管滴加蒸馏水至________相切;
③在转移液体前需要注意的是(容量瓶已查漏且洗涤干净)________________________;
④下列操作会使配制的稀硫酸物质的量浓度偏大的是________;
A.容量瓶用蒸馏水洗涤后残留有少量的水
B.量取浓溶液读数时仰视刻度线
C.移液时玻璃棒在刻度线以上
D.定容观察液体时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸具有较广泛的抑菌作用,结构简式为![]() 。下列有关说法中正确的是
。下列有关说法中正确的是
A. 该物质可以发生水解反应
B. 可以用酸性高锰酸钾溶液检验碳碳双键
C. 1 mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1∶2
D. 1 mol咖啡酸可与4 mol Br2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求完成下列各题:
(1)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是__________
(2)某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为1∶2∶1, 则溶液中Al3+和SO42-的离子个数比为__________。
(3)将一小块钠投入到盛CuSO4溶液的烧杯中,剧烈反应,放出气体并生成蓝色沉淀,其总反应的离子方程式为________________。
(4)将FeSO4溶液与过量NaOH溶液混合并在空气中放置一段时间,整个过程中的现象为______,反应过程分两步,其中第2步反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
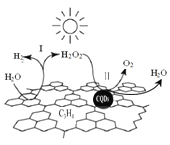
A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com