
【题目】利用光伏电池提供电能处理废水中的污染物(有机酸阴离子用R-表示),并回收有机酸HR,装置如图所示。下列说法错误的是
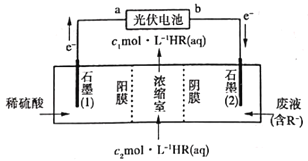
A.在光伏电池中a极为正极B.石墨(2)极附近溶液的pH降低
C.HR溶液:c2<c1D.若两极共收集3mol气体,则理论上转移4mol电子
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某同学设计了如下实验方法分离KNO3和Ba(NO3)2两种固体混合物并测定其含量:
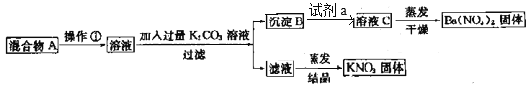
(1)操作①的名称是____________,试剂a是____________(填化学式)。
(2)加入K2CO3溶液所发生反应的离子方程式是__________。
(3)按此实验方案分离得到的KNO3,经分析含有杂质K2CO3,除去K2CO3的操作为___________
(4)过滤后洗涤沉淀B的实验操作为________________。
(5)实验前称量混合物A的质量为m g,称量经洗涤干燥后的沉淀B的质量为w g,则混合物中Ba(NO3)2质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
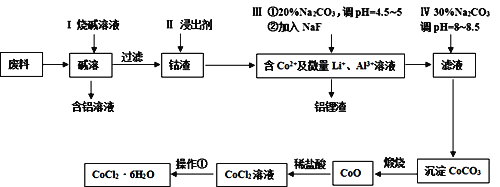
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++![]() =BaSO4↓
=BaSO4↓
B.将NaHSO4溶液滴入Ba(OH)2溶液中至溶液呈中性:2H++![]() +2OH-+Ba2+=BaSO4↓+2H2O
+2OH-+Ba2+=BaSO4↓+2H2O
C.足量CO2通入澄清石灰水中:2OH-+CO2=H2O+![]()
D.碳酸氢钙溶液与足量氢氧化钠溶液反应:Ca2++![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5gHCl溶解在1L水中(水的密度近似为1 gmL-1),所得溶液的密度为ρ gmL-1,质量分数为w,物质的量浓度为c gmL-1,NA表示阿伏加德罗常数,下列说法正确的是( )
A.所得溶液的物质的量浓度:c=1 gmL-1
B.所得溶液中含有NA个HCl分子
C.36.5 gHCl气体占有的体积为22.4L
D.所得溶液的质量分数: w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,相同物质的量浓度的下列溶液:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度按由大到小顺序排列为___________(填序数)。
(2)在25℃下,将amol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显___________(填“酸”碱”或“中)性;用含a的代数式表示NH3·H2O的电离常数Kb=___________。
(3)一定温度下,向氨水中通入CO2,得到(NH4)2CO3、NH4HCO3等物质,溶液中各种微粒的物质的量分数与pH的关系如图所示。随着CO2的通入,溶液中c(OH-)/c(NH3·H2O)将___________(填“增大”“减小”或“不变”)。pH=9时,溶液中c(NH4+)+c(H+)=___________。

(4)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂,常用于葡萄酒、果脯等食品中。在测定某葡萄酒中Na2S2O5残留量时,取25.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗5.00mL。该滴定反应的离子方程式为___________;葡萄酒中的Na2S2O5的使用量是以SO2来计算的,则该样品中Na2S2O5的残留量为___________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有:

(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是____。
(2)反应②中还原剂是________。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。
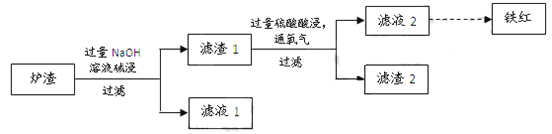
① 炉渣碱浸时反应的离子方程式是_____、_____。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是________;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO混合气体共8mol,通入足量Na2O2中,并且用电火花持续引爆,充分反应后,剩余气体1mol,则固体增重为多少克?( )
A.56gB.168gC.224gD.196g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com