
【题目】溶液中的化学反应大多数是离子反应,根据要求回答问题
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性.试用离子方程式表示:①盐碱地产生碱性的原因________、_________;
②Na2CO3溶液中离子浓度大小顺序为__________________________________________;
(2)常温下,等物质的量浓度的①氨水;②NH4HSO4;③NH4Cl;④(NH4)2CO3;⑤(NH4)2SO4溶液中,c(NH4+)由大到小的顺序为 > > > > (填序号).__________
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,水电离出来的c(OH-)=____________.
(4)常温下,将amol/L的醋酸与0.01mol/L的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显 _________(填“酸”“碱”“中”)性,用含a的代数式表示CH3COOH的电离平衡常数Ka= ________________ 。
【答案】CO32-+H2O ![]() HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O ![]() H2CO3+OH- c(Na+)>c(CO32-)>C(OH-)>c(HCO3-) >c(H+) ⑤>④>②>③>① 10-8 中性(或“中”) Ka =
H2CO3+OH- c(Na+)>c(CO32-)>C(OH-)>c(HCO3-) >c(H+) ⑤>④>②>③>① 10-8 中性(或“中”) Ka = ![]()
【解析】
(1)①碳酸盐是一种强碱弱酸盐,水解显碱性,②Na2CO3为强碱弱酸盐,CO32水解导致溶液呈碱性且第一步水解大于第二步;
(2)①是弱碱部分电离,存在电离过程;②③④⑤都是铵盐是强电解质完全电离,存在水解过程,依据弱电解质的电离和盐类水解平衡移动的影响因素解答;
(3)pH=6的CH3COOH与CH3COONa的混合溶液中的氢氧根离子是水电离,根据Kw计算水电离的c(OH-);
(4)据电荷守恒进行判断,据电离常数表达式进行计算。
(1)① 碳酸盐是一种强碱弱酸盐,碳酸根离子水解显碱性,使盐碱地显碱性,水解的离子方程式:CO32-+H2O ![]() HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O ![]() H2CO3+OH-
H2CO3+OH-
故答案为:CO32-+H2O ![]() HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O ![]() H2CO3+OH-
H2CO3+OH-
②Na2CO3为强碱弱酸盐,CO32水解导致溶液呈碱性,溶液中的电离和水解有: Na2CO3=2Na++ CO32,CO32+H2OH CO3+OH,HCO3+H2OH2CO3+OH,H2OOH+H+
根据盐的水解程度很小且第一步水解大于第二步可知:溶液中离子浓度大小顺序c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+);
(2)假设各种溶液的浓度均为1mol/L,②③④⑤都是铵盐是强电解质完全电离,④⑤电离产生的铵根离子浓度约为2mol/L,④碳酸根离子和铵根离子发生双水解相互促进,所以⑤>④;②③电离产生的铵根离子的浓度约为1mol/L,②中硫酸氢根电离产生的氢离子抑制铵根离子的水解,所以②>③;①是弱电解质只有小部分电离,铵根离子浓度远远小于1mol/L,所以铵根离子浓度由大到小的顺序是:⑤>④>②>③>①,
故答案为:⑤>④>②>③>①;
(3)pH=6的CH3COOH与CH3COONa的混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,则溶液呈酸性,该混合液中的氢氧根离子是水电离的,则水电离出的c(OH)=Kw/c(H+)=1014/106mol/L=108mol/L,
故答案为:1×108;
(4)由电荷守恒可知,c(Na+)+c(H+)=c(OH)+c(CH3COO),已知溶液中c(CH3COO)═c(Na+),则c(H+)=c(OH),即溶液显中性,呈中性则c(H+)=c(OH)=107mol/L,c(Na+)=c(CH3COO)=0.005mol/L,所以用含a的代数式表示CH3COOH的电离常数Ka=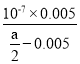 =
=![]() ,
,
故答案为:中;![]()


科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产和日常生活中有着广泛的应用。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来测定铜的相对原子质量,同时检验氯气的氧化性。
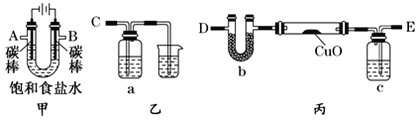
(1)装置甲中发生反应的化学方程式是:__________。
(2)已知装置甲中B处有黄绿色的气体产生,且 B连C ;则A连________(填写连接的字母)。
(3)乙装置的a瓶中溶液可以是________(填标号)
A 酸性KMnO4溶液 B CCl4溶液 C 滴加有KSCN溶液的FeCl2溶液 D 饱和食盐水
(4)在检查装置气密性后,加热丙装置硬质玻璃管里的CuO粉末前,还需要进行的操作为________。
(5)准确称量m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为____________(只要求列出算式)。该实验方案的装置有不合理之处,若不加以改进会导致测定结果__________ (填“偏大”、“偏小”或“不变”)。
(6)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧CuCl2样品时,铜的焰色为__________(填标号)。
A 绿色 B 红色 C 紫色 D 黄色
(7)向CuCl2溶液中通人H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2+ + H2S=CuS(s) + 2H+,则该反应的平衡常数K=_________(保留一位小数)。已知:CuS溶度积Ksp=1.0×10-36,H2S电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应室,在一定条件下发生反应Ⅰ:CH4(g) + H2O(g)![]() CO(g) + 3H2(g),CH4的平衡转化率与温度、压强的关系如图所示:
CO(g) + 3H2(g),CH4的平衡转化率与温度、压强的关系如图所示:
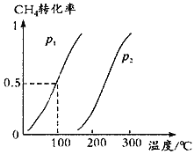
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_________;
②100℃时平衡常数为______________,在其他条件不变的情况下升高温度,化学平衡常数将_________(“减小”“不变”或“增大”);
③图中的p1______(填“>”“<”或“=”)p2;
(2)在常温、压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发发生反应Ⅱ:CO(g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的ΔH_______(填“<”“>”或“=”,下同)0,ΔS________;
②若容器容积不变,下列措施可以提高CO转化率的是_________;
A、升高温度 B、将CH3OH(g)从体系中分离出来
C、再充入1molCO和3molH2 D、充入He,使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )

A. 图中C点铝元素存在形式是AlO2—
B. 向D点溶液中通人C02气体,立即产生白色沉淀
C. 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
D. OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线不正确的是

A.向一定量![]() 溶液中滴加稀盐酸至过量
溶液中滴加稀盐酸至过量
B.向一定量含有等物质的量的![]() 、KOH的混合溶液中通入
、KOH的混合溶液中通入![]() 至沉淀消失
至沉淀消失
C.向一定量澄清石灰水中通入![]() 至过量
至过量
D.向一定量含有盐酸的![]() 溶液中滴加NaOH溶液至过量
溶液中滴加NaOH溶液至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的质量随加入的NaOH的物质的量的变化如图所示:
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的质量随加入的NaOH的物质的量的变化如图所示:

(1)由此可知,该溶液中肯定含有的离子是______________________________________,且各离子的物质的量之比为___________________________________________
(2)该溶液中肯定不含的阳离子是________________。
(3)写出NaOH的物质的量从8mol到9mol发生的离子反应方程式:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是( )
A. 淀粉、油脂和蛋白质都是天然高分子化合物
B. 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
D. 从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。

(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。


(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Prolitane 是一种抗抑郁药物,以芳香烃 A 为原料的合成路线如下:

请回答以下问题:
(1)A 的结构简式为_____。D 的化学名称为_____,
(2)E 的官能团名称分别为_____和_____。
(3)H→Prolitane 的反应类型为_____。
(4)F→G 的化学方程式为_____。
(5)C 的同分异构体中能同时满足下列条件的共有_____种(不含立体异构);
①属于芳香化合物
②能发生银镜反应
③能发生水解反应
其中核磁共振氢谱显示为 4 组峰,其峰面积比为 3∶2∶2∶1,写出符合要求的该同分异构体的结构简式_____________。
(6)参照 Prolitane 的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成路线(其他无机试剂和溶剂任选):__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com