
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应室,在一定条件下发生反应Ⅰ:CH4(g) + H2O(g)![]() CO(g) + 3H2(g),CH4的平衡转化率与温度、压强的关系如图所示:
CO(g) + 3H2(g),CH4的平衡转化率与温度、压强的关系如图所示:
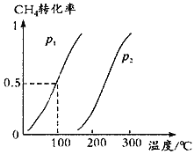
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_________;
②100℃时平衡常数为______________,在其他条件不变的情况下升高温度,化学平衡常数将_________(“减小”“不变”或“增大”);
③图中的p1______(填“>”“<”或“=”)p2;
(2)在常温、压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发发生反应Ⅱ:CO(g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的ΔH_______(填“<”“>”或“=”,下同)0,ΔS________;
②若容器容积不变,下列措施可以提高CO转化率的是_________;
A、升高温度 B、将CH3OH(g)从体系中分离出来
C、再充入1molCO和3molH2 D、充入He,使体系总压强增大
【答案】0.03mol·L-1·min-1 0.0225 增大 < < < BD
【解析】
(1)①当压强为P1,温度为100℃时CH4的平衡转化率为50%,再计算氢气的反应速率;
②根据可逆反应三段式进行计算;根据图像,升温,甲烷的转化率增大,平衡右移;
③在相同温度下,P1甲烷的转化率大于P2甲烷的转化率;
(2)①大多数的化合反应是放热反应,焓变小于零,该反应中,反应物的系数和大于产物气体系数和,所以该反应是熵减的反应;
②根据平衡移动的影响因素进行判断。
(1)①当压强为P1,温度为100℃时CH4的平衡转化率为50%,根据反应速率之比是化学计量数之比可知用H2表示0~5min内的平均反应速率为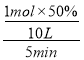 ×3=0.03mol·L-1·min-1;
×3=0.03mol·L-1·min-1;
②根据三段式可知:
CH4(g) + H2O(g)![]() CO(g) + 3H2(g)
CO(g) + 3H2(g)
开始时的浓度(mol/L) 0.1 0.2 0 0
改变的浓度(mol/L) 0.05 0.05 0.05 0.15
平衡时的浓度(mol/L) 0.05 0.15 0.05 0.15
平衡常数K=![]() =0.0225;
=0.0225;
根据图像,升温,甲烷的转化率增大,平衡右移,正反应是吸热反应,所以,在其他条件不变的情况下升高温度,化学平衡常数将增大;
③在相同温度下,P1甲烷的转化率大于P2甲烷的转化率,对于此可逆反应,增大压强,平衡左移,甲烷的转化率降低,所以,图中的P1<P2;
(2)①混合气体在催化剂作用下能自发发生反应,因此正反应是放热反应,焓变小于零,该反应中,反应物的系数和大于产物气体系数和,所以该反应是熵减的反应,熵变小于零,故答案为:<;<;
②A.该反应是放热的,升高温度,平衡逆向进行,会减小甲醇产率,选项A错误;
B.将CH3OH(g)从体系中分离,会促使平衡正向移动,提高甲醇的产率,选项B正确;
C.再充入1mol CO和3molH2,增大压强,平衡右移,有利提高甲醇的产率,选项C正确;
D.充入He,使体系总压强增大,体积不变,各组分浓度不变,所以平衡不会移动,不会改变甲醇产率,选项D错误;
答案选BD。


科目:高中化学 来源: 题型:
【题目】(1)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:

①该反应在_________min时达到化学平衡状态。
②该反应的化学方程式是______________________。
③从开始到2min,Z的平均反应速率是________________________。
(2)某原电池的装置如图所示,看到a极上有红色金属析出,回答下列问题:

①若a、b是两种活动性不同的金属,则活动性a____b(填>、<或=);
②电路中的电子从____经导线流向_____(填a或b);
③溶液中的SO42-向________极移动(填a或b);
④若两电极分别是Al和C,则负极的电极反应式为_________________。
(3)将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:

通入甲醇的电极是_____(填“正”或“负”)极,反应时该电极附近的现象是_____________________________,溶液中K+向____(填“正”或“负”)极移动:写出正极反应式:_______________;若电池工作过程中通过2mol电子,则理论上消耗O2__L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。

(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___ (能、不能)通过调节溶液pH的方法来除去,理由是_________。
(4)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______除去它们。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧杯中盛有含0.2 mol NH4Al(SO4)2的溶液,向其中缓缓加入4 mol·L-1的NaOH溶液200 mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
A. Al3+和Al(OH)3 B. AlO2— C. AlO2—和Al(OH)3 D. Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溶液中的反应,如图像中m表示生成沉淀的物质的量,n表示参加反应的某一种反应物的物质的量,则下列叙述中错误的是:
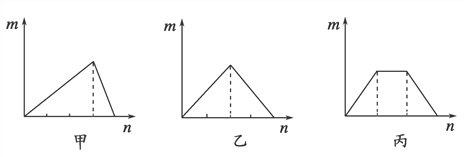
A.符合甲图像的两种反应物可以是AlCl3和NaOH
B.符合乙图像的两种反应物可以是Ca(OH)2和CO2
C.符合丙图像的反应可以是在Ca(OH)2和KOH的混合溶液中通入CO2
D.符合丙图像的反应可以是在NH4Al(SO4)2溶液中加入NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.石油、天然气和煤等化石能源都是一次能源
B.氢能是一种理想的绿色能源,现在的科学技术水平已经那个全面推广使用氢能
C.开发太阳能、水能、风能等新能源,减少使用有害物质对环境的污染
D.2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-566kJ·mol-1 ,CO的燃烧热为283kJ·mol-1
2CO2(g) ΔH=-566kJ·mol-1 ,CO的燃烧热为283kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象以及结论均正确的是
实验操作及现象 | 结论 | |
A | 取 20.00 mL盐酸 | 在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 |
B | FeCl3+3KSCN | 加入KCl晶体,氯离子浓度增大,但该平衡不移动 |
C | 加热FeCl3饱和溶液制备Fe(OH)3胶体 | 水解过程是吸热过程 |
D | 用广泛pH试纸测得NH4Cl溶液的pH为5.8 | NH4Cl水解呈酸性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多数是离子反应,根据要求回答问题
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性.试用离子方程式表示:①盐碱地产生碱性的原因________、_________;
②Na2CO3溶液中离子浓度大小顺序为__________________________________________;
(2)常温下,等物质的量浓度的①氨水;②NH4HSO4;③NH4Cl;④(NH4)2CO3;⑤(NH4)2SO4溶液中,c(NH4+)由大到小的顺序为 > > > > (填序号).__________
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,水电离出来的c(OH-)=____________.
(4)常温下,将amol/L的醋酸与0.01mol/L的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显 _________(填“酸”“碱”“中”)性,用含a的代数式表示CH3COOH的电离平衡常数Ka= ________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中,充入一定量的H2和I2(g)发生反应:I2(g)+H2(g)![]() 2HI(g) ΔH<0。t2时刻开始只改变一个条件,反应速率与反应进程的曲线关系如图所示。下列说法错误的是
2HI(g) ΔH<0。t2时刻开始只改变一个条件,反应速率与反应进程的曲线关系如图所示。下列说法错误的是
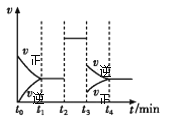
A.t0—t2时段,H2的浓度不变即体系达到平衡
B.t2时,改变的条件只有加入催化剂才能实现
C.在t4所处的平衡体系中,再加入H2,I2(g)的转化率增大
D.HI的体积分数最高的时段是t1—t2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com