
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。

(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___ (能、不能)通过调节溶液pH的方法来除去,理由是_________。
(4)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______除去它们。
A.NaOH B.FeS C.Na2S
【答案】(1)Cu2+
(2)B;
(3)不能;Co2+和Ni2+沉淀的pH范围相差太小
(4) B
【解析】(1)由图可看出,当pH=3时,Cu(OH)2的溶解度非常大,铜主要以Cu2+的形式存在
(2)若要除去CuCl2溶液中的少量Fe3+,应该调控溶液的pH,使Fe(OH)3的溶解度非常小,同时Cu(OH)2的溶解度非常大或者说Cu2+可以稳定存在,即2.5<pH<4.5范围,故选择B
(3)由于Co2+和Ni2+沉淀的pH范围相差太小,故不能通过调节溶液pH的方法来分离两种离子
(4)由溶度积常数可看出,重金属离子Cu2+、Pb2+、Hg2+的硫化物的溶度积常数远小于FeS的溶度积常数,故可工业废水中加入过量的FeS,发生沉淀的转化,特别重要的时同时析出Fe2+,避免了重金属的污染


科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
![]()
A.原子半径大小:W>Y>Z
B.X的氢化物与Z的氢化物可以发生反应
C.氧化物对应水化物的酸性:Z>Y>W
D.氢化物的稳定性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的结构简式如下图所示,下列说法不正确的是
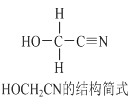
A. HOCH2CN分子中没有手性碳原子
B. 1mol HOCH2CN分子中含有σ键的物质的量为5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位数均为4
D. HOCH2CN分子中碳原子轨道的杂化类型分别是sp3和sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列有关胆矾的说法正确的是( )
A. Cu2+的价电子排布式为3d84s1
B. 所有氧原子都采取sp3杂化
C. 氧原子参与形成离子键、配位键和氢键三种化学键
D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了三个实验方案,用以检验淀粉的水解产物。
方案甲:淀粉液![]() 水解液
水解液![]() 中和液
中和液![]() 溶液变蓝
溶液变蓝
结论:淀粉没有水解
方案乙:淀粉液![]() 水解液
水解液![]() 无银镜现象
无银镜现象
结论:淀粉完全没有水解
方案丙:淀粉液![]() 水解液
水解液![]() 中和液
中和液![]() 有银镜出现
有银镜出现
结论:淀粉已经水解
根据上述操作、现象,首先回答结论是否正确,然后简要说明理由。
(1)方案甲:_________;
(2)方案乙:________;
(3)方案丙:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求答下列有关问题。
Ⅰ.由乙烷和乙烯都能制得一氯乙烷。
(1) 由乙烷制一氯乙烷的化学方程式为____________,反应类型为______________。
(2)由乙烯制一氯乙烷的化学方程式为____________,反应类型为______________。
(3)以上两种方法中_________(填“(1) ”或“(2 ) ” )更适合用来制取一氯乙烷,原因是_________________。
Ⅱ.分别用一个化学方程式解释下列问题。
(4)甲烷与氯气的混合物在漫射光下—段时间,出现白雾:__________________。
(5)溴水中通入乙烯,溴水颜色退去:_________________________。
(6)工业上通过乙烯水化获得乙醇:______________________________。
Ⅲ.(7)下列关于苯的叙述正确的是__________(填序号)。
A.苯的分子式为C6H6,它不能使酸性KmnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.二甲苯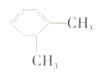 和
和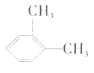 的结构不同,互为同分异构体
的结构不同,互为同分异构体
D.苯分子中的12个原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是

A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
Ⅰ.起始浓度N2:1 mol·L-1,H2:3 mol·L-1
Ⅱ.起始浓度N2:2 mol·L-1,H2:6 mol·L-1
则下列叙述正确的是( )
A. Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积分数相同
B. 达到平衡时,途径Ⅰ的反应速率v(H2)等于途径Ⅱ的反应速率v(H2)
C. 达到平衡时,途径Ⅱ体系内混合气体的压强是途径Ⅰ内混合气体压强的2倍
D. 达到平衡时,途径Ⅰ体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com