
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
![]()
A.原子半径大小:W>Y>Z
B.X的氢化物与Z的氢化物可以发生反应
C.氧化物对应水化物的酸性:Z>Y>W
D.氢化物的稳定性:Y>Z
【答案】B
【解析】
由短周期元素W、X、Y、Z在元素周期表中的相对位置可知,W位于第二周期,W元素的原子最外层电子数是内层电子数的2倍,最外层电子数为2×2=4,可知W为C,结合元素的相对位置可知,X为N,Y为S,Z为Cl,以此来解答。
由上述分析可知,W为C,X为N,Y为S,Z为Cl,
A.一般主族元素的原子电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径为S>Cl>C,故A错误;
B.NH3能和HCl反应生成NH4Cl,故B正确;
C.元素的非金属性Cl>S>C,则最高价氧化物对应水化物的酸性:HClO4>H2SO4>H2CO3,故C错误;
D.元素的非金属性Cl>S,则氢化物的稳定性:HCl>H2S,故D错误;
故答案为B。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)
A. B.
B.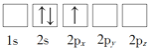
C.![]() D.
D.![]()
(2)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___________,中心原子的杂化形式为___________,LiAlH4中存在___________(填标号)
A.离子键 B.σ键 C.π键 D.氢键
(3)基态K原子中,核外电子占据最高能层的符号是___________,占据该能层电子的电子云轮廓图形状是____________;K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔沸点等都比Cr低,原因是___________
(4)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_____________、_____________
(5)气态三氧化硫以单分子形式存在,其分子的立体构型为_________,其中共价键的类型有____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。
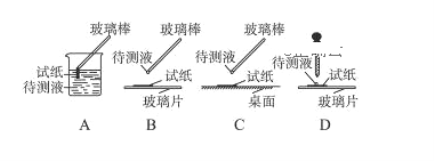
(2)根据上述实验判断原溶液中肯定存在的离子是__________,肯定不存在的离子是_________。
(3)写出与②和③两个实验有关的离子方程式:
②______________________________,③_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH=CHR2,被氧化为![]() 和
和![]() ;
;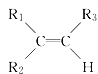 被氧化为
被氧化为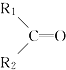 和
和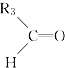 (R1 、R2 、R3 表示烃基或氢原子) 。由此推断分子式为C5H10 的烯烃所有可能的氧化产物有( )
(R1 、R2 、R3 表示烃基或氢原子) 。由此推断分子式为C5H10 的烯烃所有可能的氧化产物有( )
A.5 种B.6 种C.7 种D.8 种
查看答案和解析>>
科目:高中化学 来源: 题型:
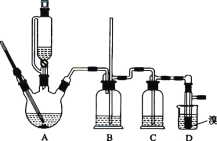
【题目】实验室用 CH3CH2OH 分两步制备 1,2-二溴乙烷。现用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm -3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A 中发生的化学方程式为 ________,反应类型为 ________,在此制备实验中,要尽可能迅速地把反应温度提高到 170 ℃左右,其最主要目的是 ________________(填字母)。
a.引发反应 b.防止乙醇挥发 c.减少副产物乙醚生成 d.加快反应速率
(2)装置B 的作用是 ________,在装置C 中应加入 ________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)装置D 中实验现象为 ________。
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置 D,其主要目的是 ________________;不用冰水原因 ________。
(6)若制得的产物中混有乙醚,得到纯净的产物的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。在压强为30MPa时,不同温度时合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据图中所示,合成氨的热化学方程式为___。
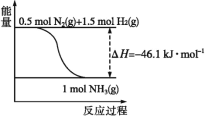
(2)将1molN2(g)和3molH2(g)通入一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“大于”“等于”或“小于”),原因是___;若加入催化剂,ΔH___(填“变大”“变小”或“不变”)。
(3)已知破坏1molN≡N键、1molH—H键需要吸收的能量分别为946kJ、436kJ,则破坏1molN—H键需要吸收的能量为___kJ。
(4)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,以NO2为氧化剂发生反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1。
则1molN2H4与NO2完全反应的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霉酚酸是一种生物活性化合物。下列有关霉酚酸的说法正确的是( )
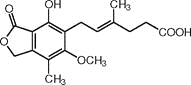
A.分子式为:C17H20O6
B.处于同一平面的碳原子至多9个
C.只有2个官能团
D.一定条件下, 1 mol霉酚酸最多可与3 mol H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下表中的空格:
微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| _______ | ___________ | ____________ | _____________ |
________ | 18 | 20 | _______________ | __________ |
____________ | ___________ | 16 | 18 | 32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com