
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:R1CH=CHR2,被氧化为![]() 和
和![]() ;
;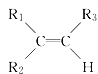 被氧化为
被氧化为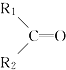 和
和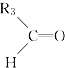 (R1 、R2 、R3 表示烃基或氢原子) 。由此推断分子式为C5H10 的烯烃所有可能的氧化产物有( )
(R1 、R2 、R3 表示烃基或氢原子) 。由此推断分子式为C5H10 的烯烃所有可能的氧化产物有( )
A.5 种B.6 种C.7 种D.8 种
 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】 合成氨工业生产中所用的α—Fe催化剂的主要成分为FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高,此时混合物中铁的质量分数为__________________(保留两位小数)。
(3)写出由C(炭粉)与Fe2O3在高温下反应制备α—Fe催化剂的化学方程式(另一种产物可溶于水):________________。
(4)为制得这种活性最高的催化剂,理论上应向480gFe2O3粉末加入炭粉的质量是______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应可用于焊接钢轨,反应为:2Al + Fe2O3 ![]() 2Fe + Al2O3,下列关于该反应说法正确的是
2Fe + Al2O3,下列关于该反应说法正确的是
A. Al 是还原剂 B. Fe2O3 发生氧化反应
C. Fe 是氧化产物 D. 当生成 1 mol Fe 时,转移 6 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1,则H2的燃烧热ΔH=-572 kJ·mol-1
B.500℃、30MPa时,发生反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1。在此条件下将1.5mol H2和过量N2充分反应,放出热量19.3kJ
2NH3(g) ΔH=-38.6kJ·mol-1。在此条件下将1.5mol H2和过量N2充分反应,放出热量19.3kJ
C.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
D.已知:2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )
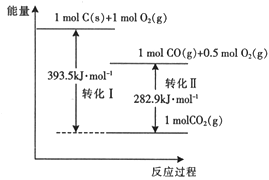
A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
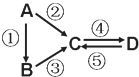
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_______________________________________;④反应离子方程式__________________________________________________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_________________________________。④反应的离子方程式_________________________。D中加入氢氧化钠的现象_____________________。
(3)若A是太阳能电池用的光伏材料,B常用于制作高档光学器材,C、D为钠盐,C的水溶液俗称水玻璃,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式___________________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
![]()
A.原子半径大小:W>Y>Z
B.X的氢化物与Z的氢化物可以发生反应
C.氧化物对应水化物的酸性:Z>Y>W
D.氢化物的稳定性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )

A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6![]() Li M1-xFexPO4+6C
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com