
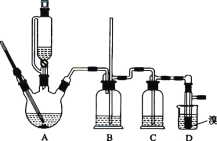
【题目】实验室用 CH3CH2OH 分两步制备 1,2-二溴乙烷。现用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm -3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A 中发生的化学方程式为 ________,反应类型为 ________,在此制备实验中,要尽可能迅速地把反应温度提高到 170 ℃左右,其最主要目的是 ________________(填字母)。
a.引发反应 b.防止乙醇挥发 c.减少副产物乙醚生成 d.加快反应速率
(2)装置B 的作用是 ________,在装置C 中应加入 ________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)装置D 中实验现象为 ________。
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置 D,其主要目的是 ________________;不用冰水原因 ________。
(6)若制得的产物中混有乙醚,得到纯净的产物的操作是________。
【答案】CH3CH2OH![]() CH2=CH2↑ + H2O 消去反应 c 安全瓶的作用 d 红棕色褪色 下 乙烯与溴反应时放热,冷却可避免溴的大量挥发 1,2二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞 蒸馏
CH2=CH2↑ + H2O 消去反应 c 安全瓶的作用 d 红棕色褪色 下 乙烯与溴反应时放热,冷却可避免溴的大量挥发 1,2二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞 蒸馏
【解析】
三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,如果D中导气管发生堵塞事故,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管可判断装置是否堵塞,装置B起缓冲作用;乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,因此要迅速提升温度至170℃,避免副反应发生,酸性气体SO2、CO2与酸不反应,二氧化碳与碳酸氢钠不反应,二氧化碳在水中溶解度不大;乙烯和溴反应生1,2-二溴乙烷,1,2-二溴乙烷与水分层,且密度比水的密度大;由表格数据可知,有机物互溶,但沸点不同,常采用蒸馏方法分离。
(1)装置A中发生的反应主要是乙醇在浓硫酸170 ℃左右反应生成乙烯和水,化学方程式为CH3CH2OH![]() CH2=CH2↑ + H2O,反应类型为消去反应,在此制备实验中,乙醇在140℃左右反应生成乙醚,因此要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;故答案为:CH3CH2OH
CH2=CH2↑ + H2O,反应类型为消去反应,在此制备实验中,乙醇在140℃左右反应生成乙醚,因此要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;故答案为:CH3CH2OH![]() CH2=CH2↑ + H2O;消去反应;c。
CH2=CH2↑ + H2O;消去反应;c。
(2)装置B中的长玻璃导管与大气相连,所以可以防倒吸,起安全瓶作用;酸性气体CO2、SO2一般常用氢氧化钠溶液吸收,二氧化碳在水中溶解度小,浓硫酸不与酸性气体CO2、SO2反应,饱和碳酸氢钠溶液不与酸性气体CO2反应,因此在装置C中应加入氢氧化钠溶液;故答案为:安全瓶的作用;d。
(3)装置D中是盛有溴单质,为红棕色,乙烯与溴反应生成1,2-二溴乙烷是无色,因此实验现象为红棕色褪色;故答案为:红棕色褪色。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,1,2二溴乙烷密度比水大,因此产物应在下层;故答案为:下。
(5)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不过度冷却(如用冰水),其原因是1,2二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞。
(6)由表格中数据可知,乙醚与1,2二溴乙烷的沸点差异较大,则若产物中有少量副产物乙醚,可用蒸馏的方法除去;故答案为:蒸馏。


科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是( )
SnI4制备SnI4。下列说法错误的是( )
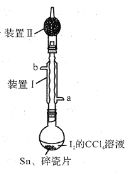
A. 加入碎瓷片的目的是防止暴沸
B. SnI4可溶于CCl4中
C. 装置Ⅰ中a为冷凝水进水口
D. 装置Ⅱ的主要作用是吸收挥发的I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成的溶液,可以发生如图转化,下列说法正确的是

A. 甲为HCl,乙为NaHCO3
B. 溶液丙中还可以大量共存的离子有:Fe2+、NO3-、SO42-
C. 在甲中滴加丁开始反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O
D. 白色沉淀A可能溶解在溶液D中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )
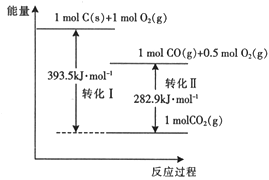
A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求作答:
(1)请根据官能团的不同对下列有机物进行分类:
① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ ⑦
⑦![]()
Ⅰ.醇: ________酮: ________醛: ________(填序号);
Ⅱ.④的官能团的名称为 ________,⑦的官能团的名称为 ________;
(2)分子式为 C4H8且属于烯烃的有机物的同分异构体有 ________种;
(3) ![]() 的名称为: ________;写出
的名称为: ________;写出![]() 聚合生成高分子化合物的化学方程式 ________;
聚合生成高分子化合物的化学方程式 ________;
(4) 键线式 表示的有机物名称为 ________;与其互为同分异构体且一氯代物有两种的烃的结构简式________;
表示的有机物名称为 ________;与其互为同分异构体且一氯代物有两种的烃的结构简式________;
(5)篮烷分子的结构如图所示:![]()
①篮烷的分子式为: ________,其二氯代物有 ________种;
②若使 1mol 该烃的所有氢原子全部被氯原子取代,需要 ________mol 氯气。
(6)某烷烃碳架结构如图所示:![]() ,此烷烃的一溴代物有 ________种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为 ________,名称为 ________;
,此烷烃的一溴代物有 ________种;若此烷烃为炔烃加氢制得,则此炔烃的结构简式为 ________,名称为 ________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
![]()
A.原子半径大小:W>Y>Z
B.X的氢化物与Z的氢化物可以发生反应
C.氧化物对应水化物的酸性:Z>Y>W
D.氢化物的稳定性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:
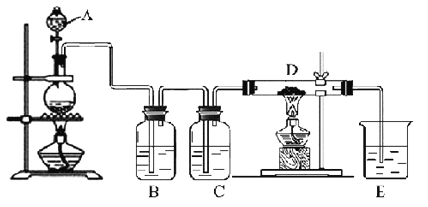
(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对液态有机物M进行如下探究实验。请回答:
Ⅰ.M组成的探究
取6.2 g有机物M在足量O2中完全燃烧后,将生成 物全部通入如图1所示装置(夹持装置略去),则:
(1)若不考虑尾气处理,该装置还有一个明显不足为____________________________。
(2)若不考虑其他因素,且生成物在A、B中全部被吸收,测得装置A增重5.4 g,装置B增重8.8 g,M的实验式为___________________,分子式为_______________________。
Ⅱ.M结构的探究
为确定M的官能团,该小组设计如图2所示装置(加持装置略)进行实验,步骤为:
①准确量取2.79 mL ρ=1.11 g·mL-1的M加入分液漏斗中;
②打开分液漏斗活塞,当M恰好全部加入a中时,迅速关闭分液漏斗活塞;
③a中反应完全后,准确读取量筒中液体体积。
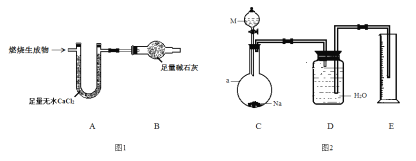
(3)a仪器的名称为__________;伸入量筒中的导管 ____(填“长”或“短”)些更合理。
(4)实验前,检验C、D部分装置气密性的方法为____________________________。
(5)第③步中,准确读取量筒读数,注意的事项为冷至室温、__________________和_____________________________。
(6)下列各项,可能导致所测气体体积偏大的为__________(填选项字母)。
A.所取M中含有少量水
B.装置C中Na过量
C.装置D、E间导管中的水没有排入量筒中
D.分液漏斗中液体M加入仪器a,将a中部分气体排入D
(7)若量筒中水的体积转化为标准状况下气体体积为560 mL,装置C中反应的化学方程式为______________________________________________(有机物用结构简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有位于前四周期的A、B、C、D、E、F六种元素,它们的核电荷数依次增大。其中C、E、F是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。F元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
(1)A是_____,B是_____,F是_____。(写元素符号)
(2)写出F元素基态原子的核外价电子排布图_____,其最高化合价为_____。
(3)含E元素的化合物灼烧的颜色是_____。很多金属盐都可以发生焰色反应,其原因是_____。
(4)请写出元素C的最高价氧化物对应的水化物与HClO4反应的离子方程式:_____。
(5)C与E的金属性强弱关系是C____E,请设计一个简单实验来证明:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com