
【题目】甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成的溶液,可以发生如图转化,下列说法正确的是

A. 甲为HCl,乙为NaHCO3
B. 溶液丙中还可以大量共存的离子有:Fe2+、NO3-、SO42-
C. 在甲中滴加丁开始反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O
D. 白色沉淀A可能溶解在溶液D中
【答案】D
【解析】
试题溶液中存在H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-,故依据离子能大量共存的原则得出甲乙丙丁中含有两种物质,即:HCl和AlCl3,因为甲溶液能和乙溶液生成沉淀,气体和氯化钠,故甲和乙中含有能双水解的离子,即Al3+和HCO3-生成的气体B为二氧化碳,沉淀A为氢氧化铝,然后依据甲与丙生成气体,则甲为NaHCO3,那么乙为AlCl3,甲与丁生成白色沉淀,则丁含有钡离子且与甲生成沉淀,则丁为氢氧化钡,丙为HCl。A、依据以上分析得出甲应为碳酸氢钠,故A错误;B、据分析可知,丙为HCl,含有H+,故Fe2+、NO3-不能与其共存,故B错误;C、甲中滴加丁,甲是过量的,那么Ba(OH)2应满足阳离子:阴离子=1:2的关系,故C错误;D、白色沉淀A为氢氧化铝能溶于强碱氢氧化钡,故D正确,故选D。


科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数的数值,则关于热化学方程式C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A. 转移10NA个电子时,该反应放出1300 kJ的能量
B. 生成NA个液态水分子时,吸收1300 kJ的能量
C. 有2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 有10NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示);
(2)已知 2SO2(g)+O2(g)=2SO3(g)△H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:
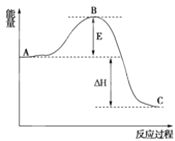
①图中A分别表示______________;
②E的大小对该反应的反应热_________(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点 __________(填“升高”“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
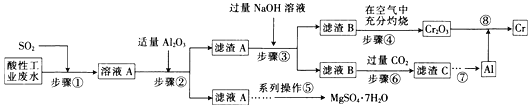
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。某工厂以酸性工业废水(含H+、Al3+、Mg2+、Cr2O72—、SO42—)以及硫酸厂废气(SO2)为原料提取铬的工艺流程如下:
有关数据如下表所示。
化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
完全沉淀的pH | 10.5 | 4.3 | 5.3 |
开始溶解的pH | — | 7.8 | 9.2 |
Ksp近似值 | 5.6×10-12 | 1.3×10-33 | 6.3×10-31 |
请回答下列问题:
(1)步骤①中发生主要反应的离子方程式为__________________________。
(2)步骤②中加入适量Al2O3的目的是__________________________。
(3)为了达到实验目的,步骤③中加入NaOH溶液,应调节溶液的pH范围为_________。
(4)步骤⑥向滤液B中通入过量CO2,反应的离子方程式为__________________________。
(5)工业上也常采用下列装置,利用电解法处理含铬废水。
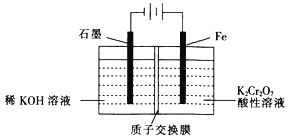
①在电解过程中阳极区pH增大的原因是_______________________。
②理论上每处理含1 mol K2Cr2O7的废水,阴极区得到的气体体积为_________(标准状况)L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是 ( )
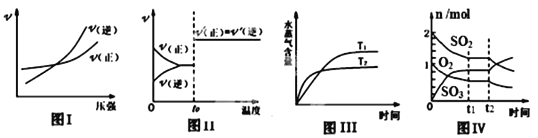
A. 图 I:反应N2+3H2![]() 2NH3在恒温情况下,反应速率与压强的关系
2NH3在恒温情况下,反应速率与压强的关系
B. 图Ⅱ:反应H2+I2![]() 2HI达平衡后,升高温度时反应速率随时间的变化
2HI达平衡后,升高温度时反应速率随时间的变化
C. 图Ⅲ:反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0,水蒸气含量随时间的变化
CO(g)+H2O(g) ΔH>0,水蒸气含量随时间的变化
D. 图Ⅳ:反应2SO2+O2![]() 2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化
2SO3达平衡后,缩小容器体积,各成分物质的量随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0。下列结论中错误( )
pC(g)+qD(g) ΔH<0。下列结论中错误( )
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若A为固体,则增大压强,平衡向逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学史的,下列说法中不正确的是
A. 道尔顿——提出原子学说 B. 爱迪生——发现电子
C. 卢瑟福——提出带核的结构模型 D. 玻尔——提出了电子在核外的量子化轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 硫酸、纯碱(Na2CO3)、氯化钠和生石灰分别属于酸、碱、盐和碱性氧化物
B. 用丁达尔效应可区别FeCl3溶液和Fe(OH)3胶体
C. 生石灰与水混合的过程只发生物理变化
D. H2O、C2H5OH、SO3均含有氧元素,都是氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com