
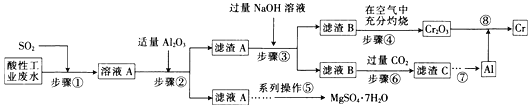
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。某工厂以酸性工业废水(含H+、Al3+、Mg2+、Cr2O72—、SO42—)以及硫酸厂废气(SO2)为原料提取铬的工艺流程如下:
有关数据如下表所示。
化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
完全沉淀的pH | 10.5 | 4.3 | 5.3 |
开始溶解的pH | — | 7.8 | 9.2 |
Ksp近似值 | 5.6×10-12 | 1.3×10-33 | 6.3×10-31 |
请回答下列问题:
(1)步骤①中发生主要反应的离子方程式为__________________________。
(2)步骤②中加入适量Al2O3的目的是__________________________。
(3)为了达到实验目的,步骤③中加入NaOH溶液,应调节溶液的pH范围为_________。
(4)步骤⑥向滤液B中通入过量CO2,反应的离子方程式为__________________________。
(5)工业上也常采用下列装置,利用电解法处理含铬废水。
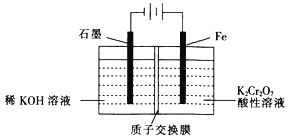
①在电解过程中阳极区pH增大的原因是_______________________。
②理论上每处理含1 mol K2Cr2O7的废水,阴极区得到的气体体积为_________(标准状况)L。
【答案】Cr2O72—+3SO2+2H+=2 Cr3++3SO42—+H2O 调节溶液的pH,使Cr3+、Al3+形成沉淀而与Mg2+分离 7.8≤pH<9.2 AlO2—+CO2+2 H2O=Al(OH)3↓+HCO3— Fe2+与![]() 发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区 134.4
发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区 134.4
【解析】
(1)步骤①中,SO2有还原性,Cr2O72—在酸性条件下具有强氧化性,二者发生氧化还原反应。
(2)根据题中表格数据,步骤②中加入适量Al2O3的目的是:调节溶液的pH,使Cr3+、Al3+形成沉淀而与Mg2+分离。
(3)步骤③中的滤渣A为:Al(OH)3和Cr(OH)3,加入NaOH溶液使氢氧化铝溶解。
(4)步骤⑥向滤液B中通入过量CO2,滤液B为偏铝酸钠溶液,偏铝酸钠溶液和过量CO2反应生成Al(OH)3和碳酸氢钠。
(5)①右侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中Cr2O72-氧化,发应生成Cr3+和Fe3+。
②阴极氢离子放电生成氢气,2H++2e-=H2↑,阳极反应为:Fe-2e-= Fe2+。
(1)步骤①中,SO2有还原性,Cr2O72—在酸性条件下具有强氧化性,故发生主要反应的离子方程式为:Cr2O72—+3SO2+2H+=2 Cr3++3SO42—+H2O,故答案为:Cr2O72—+3SO2+2H+=2 Cr3++3SO42—+H2O。
(2)根据题中表格数据,步骤②中加入适量Al2O3的目的是:调节溶液的pH,使Cr3+、Al3+形成沉淀而与Mg2+分离,故答案为:调节溶液的pH,使Cr3+、Al3+形成沉淀而与Mg2+分离。
(3)步骤③中的滤渣A为:Al(OH)3和Cr(OH)3,加入NaOH溶液使氢氧化铝溶解,故调节溶液的pH范围为:7.8≤pH<9.2,故答案为:7.8≤pH<9.2。
(4)步骤⑥向滤液B中通入过量CO2,滤液B为偏铝酸钠溶液,偏铝酸钠溶液和过量CO2反应生成Al(OH)3和碳酸氢钠,反应的离子方程式为:AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—,故答案为:AlO2—+CO2+2 H2O=Al(OH)3↓+HCO3—。
(5)①右侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中Cr2O72-氧化,发应生成Cr3+和Fe3+,反应的离子方程式:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故在电解过程中阳极区pH增大的原因是:Fe2+与![]() 发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区,故答案为:Fe2+与
发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区,故答案为:Fe2+与![]() 发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区。
发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区。
②阴极氢离子放电生成氢气,2H++2e-=H2↑,阳极反应为:Fe-2e-= Fe2+,根据此反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,可知1 molK2Cr2O7和6molFe2+反应,所以阳极每生成6molFe2+,失去12mol电子,根据得失电子守恒可知:阴极区生成氢气为6mol,标况下氢气的体积为:134.4L,故答案为:134.4。


科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.同种元素的质子数必定相同
B.不同元素原子的质量数必定不同
C.原子核都是由质子和中子构成的
D.凡是核外电子数相同的微粒必定属于同一元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基法提纯粗镍涉及的两步反应依次为:
(1)Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH < 0 (2)Ni(CO)4(g)
Ni(CO)4(g) ΔH < 0 (2)Ni(CO)4(g) ![]() Ni(s)+4CO(g),下列说法正确的是
Ni(s)+4CO(g),下列说法正确的是
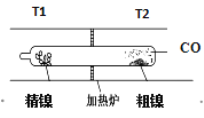
A. T1<T2
B. 可通过高压的方式提高反应(1)中Ni(CO4)的产率
C. 反应(2)平衡后,降低温度,CO浓度减小
D. 升温,反应(1)的气体平均相对分子质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
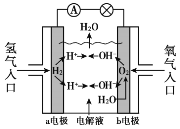
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________。
(2)铜与钾处于同周期且最外层电子数相同,铜的熔沸点及硬度均比钾大,其原因是___________________________。
(3)NH3分子的立体构型为_________,中心原子的杂化类型是_________。
(4)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________,电负性最小的是_________。(填元素符号)
(5)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________ (填“离子晶体”或“分子晶体”,下同),CuCl为_________。
(6)氮与铜形成的一种化合物的晶胞结构如图所示。
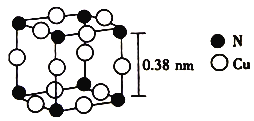
与每个Cu原子紧邻的Cu原子有_________个,阿伏加德罗常数的数值为NA,该晶体的密度为_________ (列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成的溶液,可以发生如图转化,下列说法正确的是

A. 甲为HCl,乙为NaHCO3
B. 溶液丙中还可以大量共存的离子有:Fe2+、NO3-、SO42-
C. 在甲中滴加丁开始反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O
D. 白色沉淀A可能溶解在溶液D中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关金属的冶炼原理下列说法正确的是( )
A. 肯定发生的是置换反应 B. 肯定发生的是分解反应
C. 肯定发生的是氧化还原反应 D. 只能用金属做还原剂冶炼金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com