
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是( )
SnI4制备SnI4。下列说法错误的是( )
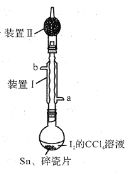
A. 加入碎瓷片的目的是防止暴沸
B. SnI4可溶于CCl4中
C. 装置Ⅰ中a为冷凝水进水口
D. 装置Ⅱ的主要作用是吸收挥发的I2
 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
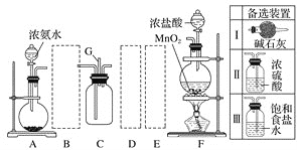
请回答下列问题:
(1)装置A中的烧瓶内固体可选用__(填字母)。
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从表格中的备选装置中选择,并将编号填入下列空格:B__,D__,E__。
(3)通入C装置的两根导管左边较长、右边较短,目的是__。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:__;其中氧化剂与还原剂的物质的量之比为__;当amol氯气参加反应时,转移的电子总数为b个,则阿伏加德罗常数为__mol-1(用含a、b的代数式表示)。
(5)从装置C的出气管口G处逸出的尾气可能含有污染环境的气体,如何处理?_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c的分子式均为C8H8
B. a、b、c均能与溴水发生反应
C. a、b、c中只有a的所有原子会处于同一平面
D. a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是

A. 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(![]() )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)
A. B.
B.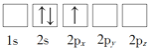
C.![]() D.
D.![]()
(2)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___________,中心原子的杂化形式为___________,LiAlH4中存在___________(填标号)
A.离子键 B.σ键 C.π键 D.氢键
(3)基态K原子中,核外电子占据最高能层的符号是___________,占据该能层电子的电子云轮廓图形状是____________;K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔沸点等都比Cr低,原因是___________
(4)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_____________、_____________
(5)气态三氧化硫以单分子形式存在,其分子的立体构型为_________,其中共价键的类型有____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为电子层数小于或等于3的元素,A元素原子M层电子数为K层电子数的![]() ,B元素原子M层电子数为次外层与最内层电子数之差,C元素原子L层达稳定结构所需电子数为该层电子数的
,B元素原子M层电子数为次外层与最内层电子数之差,C元素原子L层达稳定结构所需电子数为该层电子数的![]() 。由此推断三种元素原子的核电荷数及元素名称分别是A__________;B________;C________。
。由此推断三种元素原子的核电荷数及元素名称分别是A__________;B________;C________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六种溶液:①0.01mol·L-1CH3COOH溶液;②0.01mol·L-1HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)将②③混合后所得溶液pH=7,则消耗溶液的体积:②__(填“>”“<”或“=”)③。
(2)若将②③等体积混合后,则所得混合溶液中各离子浓度大小顺序为__。
(3)将六种溶液稀释100倍后,比较溶液的pH:③__(填“>”“<”或“=”)④。
(4)水的电离程度相同的是__(填序号)。
(5)将①④混合,若有c(CH3COO-)>c(Na+),则混合液呈_(填字母)。
A.酸性 B.碱性 C.中性 D.三性皆有可能
(6)若改变温度后,测得④溶液pH=10,则该温度下Kw=__。在该温度下,将①④混合后,测得溶液pH=7,则所得溶液中c(Na+)-c(CH3COO-)=__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 CH3CH2OH 分两步制备 1,2-二溴乙烷。现用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
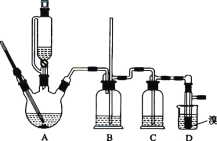
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm -3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A 中发生的化学方程式为 ________,反应类型为 ________,在此制备实验中,要尽可能迅速地把反应温度提高到 170 ℃左右,其最主要目的是 ________________(填字母)。
a.引发反应 b.防止乙醇挥发 c.减少副产物乙醚生成 d.加快反应速率
(2)装置B 的作用是 ________,在装置C 中应加入 ________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)装置D 中实验现象为 ________。
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置 D,其主要目的是 ________________;不用冰水原因 ________。
(6)若制得的产物中混有乙醚,得到纯净的产物的操作是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com