
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:
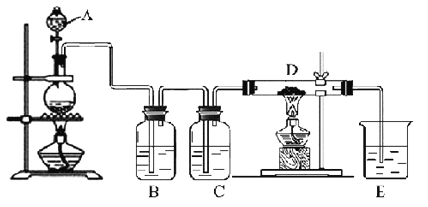
(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
【答案】分液漏斗 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 饱和NaCl溶液 吸收氯气中混有的杂质HCl 浓硫酸 2Fe+3Cl2![]() 2FeCl3 氢氧化钠溶液 Cl2+2OH﹣=Cl﹣+ClO﹣+H2O 干燥
2FeCl3 氢氧化钠溶液 Cl2+2OH﹣=Cl﹣+ClO﹣+H2O 干燥
【解析】
实验室用二氧化锰和浓盐酸共热制备氯气,因浓盐酸具有挥发性,制得的氯气中混有氯化氢和水蒸气,要得到纯净的氯气,应除去氯化氢和水蒸气,可以依次通过盛有饱和食盐水、浓硫酸的洗气瓶进行除杂,氯气与铁在加热条件下反应生成氯化铁,氯气有毒,直接排放到空气中能够污染空气,应进行尾气处理,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,可以选择氢氧化钠溶液吸收过量的氯气。
(1)仪器A的名称是分液漏斗;烧瓶中二氧化锰和浓盐酸共热反应生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:分液漏斗;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:分液漏斗;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到纯净的氯气,应除去氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择盛有饱和食盐水的B装置除去氯化氢,浓硫酸具有吸水性,可以干燥氯气,所以选择盛有浓硫酸的洗气瓶C除去水蒸气,故答案为:饱和NaCl溶液;吸收氯气中混有的杂质HCl;浓硫酸;
(3)装置D中氯气和铁共热发生化合反应生成氯化铁,反应的化学方程式为2Fe+3Cl2![]() 2FeCl3,故答案为:2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(4)氯气有毒,直接排放到空气中能够污染空气,应进行尾气处理,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,可以选择氢氧化钠溶液吸收过量的氯气,故答案为:NaOH溶液;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
(5)由题给资料可知反应生成的氯化铁①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应,则制备时需要防止水蒸气进入装置D,为收集D中产物,在D与E之间,除增加收集装置外,还需要增加干燥装置,防止装置E中水蒸气进入,故答案为:干燥。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
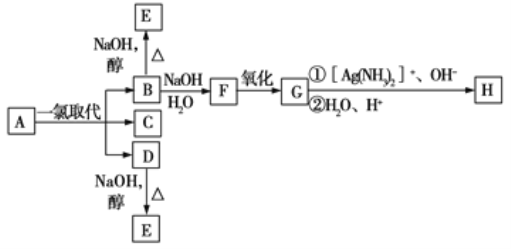
【题目】烷烃A只可能有三种一氯取代产物B、C、D,C的结构简式是![]() ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如图所示:
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如图所示:
已知:R-CHO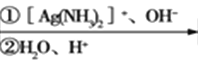 R-COOH
R-COOH
请回答下列问题:
(1)A的结构简式是______。
(2)H的结构简式是______。
(3)B转变为F的反应属于_____反应(填反应类型名称)。
(4)B转变为E的反应属于____反应(填反应类型名称)。
(5)1.16gH与足量的NaHCO3作用,标准状况下可得CO2的体积是____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO32-、OH-,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,正确的操作顺序是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③
C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:___________;磷原子核外有_____种能量不同的电子。
(2)上述反应的反应物和生成物中含有非极性键的分子是______。(写出物质的化学式)
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列___________________。
(4)NH3的稳定性比PH3的(填“强”或“弱”)_________,判断理由是____________。
(5)A、配平上述反应,并标出电子转移方向与数目_________
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1mol氧化产物,转移电子的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分:Al2O3、SiO2、少量Fe2O3)为原料,制取Al2O3的部分工艺流程如下:

完成下列填空:
(1)铝原子核外有_____种不同能量的电子,最外层电子的轨道式是_____________,上述流程涉及第二周期元素的原子半径由小到大的顺序是______________________________。
(2) “除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为______________________,检验溶液中Fe3+是否除尽的方法是____________________________________________。
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。______________________
(4)上述流程可循环的物质是_______________。
(5)工业上将Al2O3溶解在熔化的冰晶石中电解获得铝,该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 mL浓度均为0.1 mol/L的AlCl3与MgCl2混合溶液中,加入60 mL、0.1 mol/L的NaOH溶液后,铝元素的存在形式是
A.Al3+、Al(OH)3B.Al(OH)3C.![]() lO2-、Al(OH)3D.
lO2-、Al(OH)3D.![]() lO2-
lO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______(填化学式),呈现如此递变规律的原因是________________________________。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___,另一种的晶胞如图二所示,该晶胞的空间利用率为________________(保留两位有效数字)。(![]() )
)
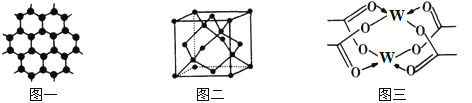
(4)W元素形成的单质,其晶体的堆积模型为___________,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________。请写出上述过程的离子方程式___________________________ ,___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
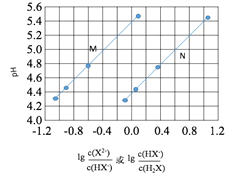
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com