
【题目】某学习小组对液态有机物M进行如下探究实验。请回答:
Ⅰ.M组成的探究
取6.2 g有机物M在足量O2中完全燃烧后,将生成 物全部通入如图1所示装置(夹持装置略去),则:
(1)若不考虑尾气处理,该装置还有一个明显不足为____________________________。
(2)若不考虑其他因素,且生成物在A、B中全部被吸收,测得装置A增重5.4 g,装置B增重8.8 g,M的实验式为___________________,分子式为_______________________。
Ⅱ.M结构的探究
为确定M的官能团,该小组设计如图2所示装置(加持装置略)进行实验,步骤为:
①准确量取2.79 mL ρ=1.11 g·mL-1的M加入分液漏斗中;
②打开分液漏斗活塞,当M恰好全部加入a中时,迅速关闭分液漏斗活塞;
③a中反应完全后,准确读取量筒中液体体积。
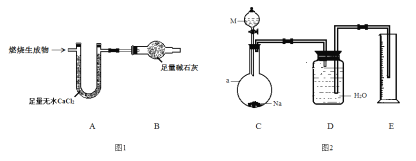
(3)a仪器的名称为__________;伸入量筒中的导管 ____(填“长”或“短”)些更合理。
(4)实验前,检验C、D部分装置气密性的方法为____________________________。
(5)第③步中,准确读取量筒读数,注意的事项为冷至室温、__________________和_____________________________。
(6)下列各项,可能导致所测气体体积偏大的为__________(填选项字母)。
A.所取M中含有少量水
B.装置C中Na过量
C.装置D、E间导管中的水没有排入量筒中
D.分液漏斗中液体M加入仪器a,将a中部分气体排入D
(7)若量筒中水的体积转化为标准状况下气体体积为560 mL,装置C中反应的化学方程式为______________________________________________(有机物用结构简式表示)。
【答案】B装置后未连接阻止外界空气进入的装置,会导致所测CO2质量偏高。(其他合理答案也给分) CH3O C2H6O2 圆底烧瓶 长 (4)关闭分液漏斗活塞,将量筒中的导管下口没入水面下,用热毛巾捂住圆底烧瓶(或a仪器)中上部,导管口有气泡冒出,撤掉毛巾,导管中进入一段水柱,则C、D部分装置气密性良好。(其他合理答案也给分) 调整量筒高度,使D、E中水面相平 视线与量筒中凹液面最低点的切线相平 A D 2CH3OCH2OH+2Na→2CH3OCH2ONa+H2↑
【解析】
Ⅰ、对M组成的探究取6.2g有机物M在足量O2中完全燃烧后,将生成物全部通入如图1装置,燃烧产物通过足量无水氯化钙吸收生成的水蒸气,通过装置B中碱石灰吸收生成的二氧化碳,最后装置C中碱石灰防止空气中水蒸气和二氧化碳进入装置B影响测定准确度;
(1)、由题中信息知,图1中装置A为测定生成水的质量,装置B为测定生成的CO2质量,故整套装置末端应加装个隔绝空气中的水和CO2进入的装置;
(2)、若不考虑其他因素,且生成物在A、B中全部被吸收,测得装置A增重5.4g为生成的水蒸气足量,装置B增重8.8g为生成的二氧化碳气体质量,结合元素守恒计算有机物的最简式、确定分子式;
Ⅱ、对M结构的探究
(3)、依据装置中图象分析仪器名称;
(5)、根据水面的特点明确量筒中液体体积;
(6)、M和钠反应生成氢气,若量筒中水的体积转化为标准状况下气体体积为560mL,计算生成氢气物质的量和M物质的量,据此判断羟基个数,得到M的结构简式,再写出方程式。
(1)、①由题中信息知,图1中装置A为测定生成水的质量,装置B为测定生成的CO2质量,故整套装置末端应加装个隔绝空气中的水和CO2进入的装置;
故答案为:B装置后未连接阻止外界空气进入的装置,会导致所测CO2质量偏高;
(2)、5.4gH2O的物质的量0.3 mol,其中H原子为0.6mol,8.8gCO2的物质的量为0.2mol,其中C原子0.2mol,根据有机物的质量6.2g,可知有机物中含有氧元素,其物质的量为0.2mol,可得最简式CH3O,CH3O不满足C四键或者O的二键原则,将最简式中各原子数增大1倍得C2H6O2,其中C、H原子达到烷烃的比例,可知其分子式为:C2H6O2,
故答案为:CH3O;C2H6O2;
(3)、由装置图可知a为圆底烧瓶,伸入量筒的导管应尽量接近底部,这样在冷却过程中量筒中的水才可以回流到广口瓶中;
故答案为:圆底烧瓶;长;
(4)、检验装置的气密性时需体现形成密闭体系、产生压强差、描述现象、得到结论四个环节;
故答案为:关闭分液漏斗活塞,将量筒中的导管下口没入水面下,用热毛巾捂住圆底烧瓶(或a仪器)中上部,导管口有气泡冒出,撤掉毛巾,导管中进入一段水柱,则C、D部分装置气密性良好;
(5)、测定气体体积需在常温常压下进行,可知三个注意事项,
故答案为:调整量筒高度,使D、E中水面相平;视线与量筒中凹液面最低点的切线相平;
(6)A、根据水和M的密度、摩尔质量大小,则等体积的水的物质的量大于M,生成H2的体积大于M,A项正确;
B、Na过量可使M完全反应,使测定结果准确,B项情误;
C、装置D、E导管间中的水没有排入量筒中使所测结果偏小,C项错误;
D、液体M加入仪器a,液体体积占用烧瓶空间,多排出气体,所测气体体积偏大,D项正确;
故选AD;
(7)、M的物质的量为![]() ,H2的物质的量为
,H2的物质的量为![]() ,则M与H2的物质的量之比为1:1,可知M的结构简式为CH3OCH2OH,可写化学方程式;
,则M与H2的物质的量之比为1:1,可知M的结构简式为CH3OCH2OH,可写化学方程式;
故答案为:2CH3OCH2OH+2Na→2CH3OCH2ONa+H2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有常温下的六种溶液:①0.01mol·L-1CH3COOH溶液;②0.01mol·L-1HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol·L-1CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol·L-1HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)将②③混合后所得溶液pH=7,则消耗溶液的体积:②__(填“>”“<”或“=”)③。
(2)若将②③等体积混合后,则所得混合溶液中各离子浓度大小顺序为__。
(3)将六种溶液稀释100倍后,比较溶液的pH:③__(填“>”“<”或“=”)④。
(4)水的电离程度相同的是__(填序号)。
(5)将①④混合,若有c(CH3COO-)>c(Na+),则混合液呈_(填字母)。
A.酸性 B.碱性 C.中性 D.三性皆有可能
(6)若改变温度后,测得④溶液pH=10,则该温度下Kw=__。在该温度下,将①④混合后,测得溶液pH=7,则所得溶液中c(Na+)-c(CH3COO-)=__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 CH3CH2OH 分两步制备 1,2-二溴乙烷。现用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
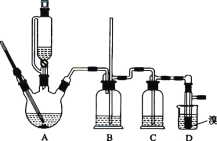
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm -3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A 中发生的化学方程式为 ________,反应类型为 ________,在此制备实验中,要尽可能迅速地把反应温度提高到 170 ℃左右,其最主要目的是 ________________(填字母)。
a.引发反应 b.防止乙醇挥发 c.减少副产物乙醚生成 d.加快反应速率
(2)装置B 的作用是 ________,在装置C 中应加入 ________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)装置D 中实验现象为 ________。
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置 D,其主要目的是 ________________;不用冰水原因 ________。
(6)若制得的产物中混有乙醚,得到纯净的产物的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霉酚酸是一种生物活性化合物。下列有关霉酚酸的说法正确的是( )
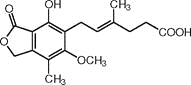
A.分子式为:C17H20O6
B.处于同一平面的碳原子至多9个
C.只有2个官能团
D.一定条件下, 1 mol霉酚酸最多可与3 mol H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然碱可看作由CO2和NaOH反应后的产物所组成。为了确定其组成,现称取天然碱3.32g,做如下实验:(气体均折算为标准状况下)

(1)B的电子式_______。
(2)天然碱受热分解的反应方程式______。
(3)过量的天然碱溶液滴加少量的Ba(OH)2溶液,请写出离子反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融碳酸盐燃料电池简称MCFC ,具有高发电效率,工作原理示意图如图。下列有关说法正确的是
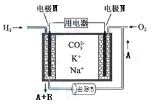
A. 电极M为负极,K+、Na+移向M
B. 电池工作时,熔融盐中CO32-物质的量增大
C. A 为CO2,正极的电极反应为:O 2+4e -+2CO2 = 2CO32 -
D. 若用MCFC给铅蓄电池充电,电极N接Pb极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为单质,其中A为用途广泛的金属单质,B为黄绿色气体,B与C反应后的产物E溶于水得无色酸性溶液。A、B、C之间的其他反应如图所示。
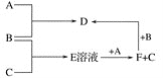
试填空:
(1)写出下列物质的化学式:
B________,D________,F________。
(2)鉴别D溶液中阳离子的方法是________________________。
(3)写出下列反应的离子方程式:
①A+E→F+C:____________________________________________________。
②B+F→D:________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com