
【题目】A、B、C均为单质,其中A为用途广泛的金属单质,B为黄绿色气体,B与C反应后的产物E溶于水得无色酸性溶液。A、B、C之间的其他反应如图所示。
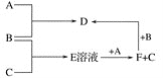
试填空:
(1)写出下列物质的化学式:
B________,D________,F________。
(2)鉴别D溶液中阳离子的方法是________________________。
(3)写出下列反应的离子方程式:
①A+E→F+C:____________________________________________________。
②B+F→D:________________________________________________。
【答案】Cl2 FeCl3 FeCl2 取少量D溶液于试管中,然后滴加KSCN溶液,溶液呈红色表明含Fe3+ Fe+2H+===Fe2++H2↑ 2Fe2++Cl2===2Fe3++2Cl-
【解析】
由“B为黄绿色气体 ”知B为氯气;由“B与C反应后的产物E溶于水得无色酸性溶液”知E为HCl,进而可知C为H2 ;
由“E+A→F+C,即 HCl+A→F+H 2 ” 知A为金属单质且F为盐;由“A+B→D,即A+Cl2→D” 知D为盐;
再由 “F+B→D,即 F+Cl2→D”知D 、F中A元素的化合价不同,即A为变价金属,可考虑A为铁,D为 FeCl3,F为FeCl2。
(1)由以上分析可知B为:Cl2、D为 FeCl3、F为FeCl2,
故答案为:Cl2 ; FeCl3 ;FeCl2 ;
(2)D溶液为FeCl3溶液,其阳离子为Fe3+,能与KSCN溶液反应,使溶液呈红色,
故答案为:取少量D溶液于试管中,然后滴加KSCN溶液,溶液呈红色表明含Fe3+ ;
(3)①A为Fe,E为HCl,二者反应生成氯化亚铁和氢气,离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
②B为氯气,F为氯化亚铁,二者反应生成氯化铁,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某学习小组对液态有机物M进行如下探究实验。请回答:
Ⅰ.M组成的探究
取6.2 g有机物M在足量O2中完全燃烧后,将生成 物全部通入如图1所示装置(夹持装置略去),则:
(1)若不考虑尾气处理,该装置还有一个明显不足为____________________________。
(2)若不考虑其他因素,且生成物在A、B中全部被吸收,测得装置A增重5.4 g,装置B增重8.8 g,M的实验式为___________________,分子式为_______________________。
Ⅱ.M结构的探究
为确定M的官能团,该小组设计如图2所示装置(加持装置略)进行实验,步骤为:
①准确量取2.79 mL ρ=1.11 g·mL-1的M加入分液漏斗中;
②打开分液漏斗活塞,当M恰好全部加入a中时,迅速关闭分液漏斗活塞;
③a中反应完全后,准确读取量筒中液体体积。
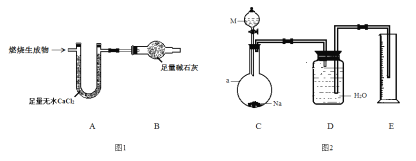
(3)a仪器的名称为__________;伸入量筒中的导管 ____(填“长”或“短”)些更合理。
(4)实验前,检验C、D部分装置气密性的方法为____________________________。
(5)第③步中,准确读取量筒读数,注意的事项为冷至室温、__________________和_____________________________。
(6)下列各项,可能导致所测气体体积偏大的为__________(填选项字母)。
A.所取M中含有少量水
B.装置C中Na过量
C.装置D、E间导管中的水没有排入量筒中
D.分液漏斗中液体M加入仪器a,将a中部分气体排入D
(7)若量筒中水的体积转化为标准状况下气体体积为560 mL,装置C中反应的化学方程式为______________________________________________(有机物用结构简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有位于前四周期的A、B、C、D、E、F六种元素,它们的核电荷数依次增大。其中C、E、F是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。F元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
(1)A是_____,B是_____,F是_____。(写元素符号)
(2)写出F元素基态原子的核外价电子排布图_____,其最高化合价为_____。
(3)含E元素的化合物灼烧的颜色是_____。很多金属盐都可以发生焰色反应,其原因是_____。
(4)请写出元素C的最高价氧化物对应的水化物与HClO4反应的离子方程式:_____。
(5)C与E的金属性强弱关系是C____E,请设计一个简单实验来证明:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是

A.粗盐可采用除杂和重结晶等过程提纯
B.向苦卤中通入Cl2 是为了提取溴
C.实际生产中常选用Ca(OH)2 作为沉淀剂
D.工业生产中电解熔融氧化镁的方法制取镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种理想的绿色高效水处理剂。某学习小组用下图所示装置(夹持仪器已略去)制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备K2FeO4。

查阅资料知K2FeO4的部分性质如下:①可溶于水、微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
请回答下列问题:
(1)仪器C和D中都盛有KOH溶液,其中C中KOH溶液的用途是_________________。
(2)Cl2与KOH的浓溶液在较高温度下反应生成KClO3。为保证反应生成KClO,需要将反应温度控制在0~5℃下进行,在不改变KOH溶液浓度的前提下,实验中可以采取的措施是___________。
(3)在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,写出该反应的化学方程式____________________________________________;该操作不能将KClO饱和溶液滴加到Fe(NO3)3饱和溶液中,其原因是________________________________________。
(4)制得的粗产品中含有Fe(OH)3、KCl等杂质。一种提纯方案为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置,再用砂芯漏斗过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
①第一次和第二次过滤得到的固体分别对应的是(填化学式)______________、___________,过滤时不用普通漏斗而采用砂芯漏斗的原因是_____________________。
②晶体用乙醇洗涤的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2, 其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2 以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________,“氨浸”后生成( NH4)2 MoO4反应的化学方程式为___________。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2 MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数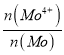 为__________。
为__________。
(6)钼酸钠晶体( Na2 MoO4 2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8 , Ksp(BaSO4)=1.1×10-10]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Al(OH)3固体的熔点为300℃,电离方程式为H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() 3OH-+Al3+;②无水AlCl3晶体易升华,溶于水的电离方程式为AlCl3=Al3++3Cl-;③熔融状态的HgCl2不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于Al(OH)3、AlCl3和HgCl2的说法正确的是( )
3OH-+Al3+;②无水AlCl3晶体易升华,溶于水的电离方程式为AlCl3=Al3++3Cl-;③熔融状态的HgCl2不能导电,稀溶液具有弱的导电能力且可作为手术刀的消毒液,下列关于Al(OH)3、AlCl3和HgCl2的说法正确的是( )
A.均为强电解质B.均为弱电解质
C.均为离子化合物D.均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:2Sb2S3+3O2+6Fe=Sb4O6+6FeS①;Sb4O6+6C=4Sb+6CO②。下列说法正确的是( )
A. 反应②说明高温下Sb还原性比C强
B. 反应①中每生成1 mol FeS时,共转移2mol电子
C. 每生成1 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
D. 反应①②中氧化剂分别是Sb2S3、Sb4O6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com