
����Ŀ�����ڹ�ũҵ������Ӧ�ù㷺����ѹǿΪ30MPaʱ����ͬ�¶�ʱ�ϳɰ�ƽ����������NH3������������£�
�¶�/�� | 200 | 300 | 400 | 500 | 600 |
������/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
��ش�
��1������ͼ����ʾ���ϳɰ����Ȼ�ѧ����ʽΪ___��
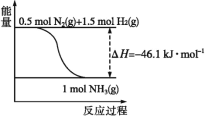
��2����1molN2(g)��3molH2(g)ͨ��һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������___92.2kJ(����������������������С����)��ԭ����___���������������H___(�������������С������������)��
��3����֪�ƻ�1molN��N����1molH��H����Ҫ���յ������ֱ�Ϊ946kJ��436kJ�����ƻ�1molN��H����Ҫ���յ�����Ϊ___kJ��
��4��N2H4����ΪNH3�����е�һ��H����NH2ȡ���IJ������������N2H4(g)Ϊȼ�ϣ���NO2Ϊ������������Ӧ����N2��H2O(g)��
��֪��N2(g)+2O2(g)=2NO2(g) ��H1=+67.7kJ��mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H2=-534kJ��mol-1��
��1molN2H4��NO2��ȫ��Ӧ���Ȼ�ѧ����ʽΪ___��
���𰸡�N2(g)+3H2(g)![]() 2NH3(g) ��H=-92.2kJ��mol-1 С�� ���ڸ÷�Ӧ�ǿ��淴Ӧ����Ӧ����ȫ��ת��Ϊ������ ���� 391 N2H4(g)+NO2(g)=N2(g)+2H2O(g) ��H=-567.85kJmol-1
2NH3(g) ��H=-92.2kJ��mol-1 С�� ���ڸ÷�Ӧ�ǿ��淴Ӧ����Ӧ����ȫ��ת��Ϊ������ ���� 391 N2H4(g)+NO2(g)=N2(g)+2H2O(g) ��H=-567.85kJmol-1
��������
��1����ͼ��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ��
��2���ϳɰ��ķ�ӦΪ���淴Ӧ����������ܽ��ͷ�Ӧ�Ļ�ܣ�
��3��������H=��Ӧ����ܼ���-��������ܼ��ܽ��м��㣻
��4�����ݸ�˹���ɽ��м��㣬��д�Ȼ�ѧ����ʽ��
��1����ͼ��֪��1molN2(g)��1.5molH2(g)��ȫ��Ӧ����1molNH3(g)�ķ�Ӧ����H=-46.1kJ��mol-1�����Ժϳɰ����Ȼ�ѧ��Ӧ����ʽΪN2(g)+3H2(g)![]() 2NH3(g) ��H=-92.2kJ��mol-1��
2NH3(g) ��H=-92.2kJ��mol-1��
��2���ϳɰ���Ӧ�ǿ��淴Ӧ����Ӧ�ﲻ����ȫת��Ϊ�����3molH2��1molN2���뷴Ӧ����������2molNH3���ʷų�������С��92.2kJ�������ɽ��ͷ�Ӧ�Ļ�ܣ��ɸı䷴Ӧ���ʵ����ı仯ѧƽ�⣬��Ӧ�Ȳ��䣻
��3����֪�ƻ�1molN��N����1molH��H����Ҫ���յ������ֱ�Ϊ946kJ��436kJ�����ƻ�1molN��H����Ҫ���յ�����Ϊx����Ϸ�ӦN2(g)+3H2(g)![]() 2NH3(g) ��H=-92.2kJ��mol-1��������H=��Ӧ������ܺ�-����������ܺ�=946kJ��mol-1+3��436 kJ��mol-1-6x=-92.2kJ��mol-1��x=391kJ��mol-1�����ƻ�1molN��H����Ҫ���յ�����Ϊ391kJ��
2NH3(g) ��H=-92.2kJ��mol-1��������H=��Ӧ������ܺ�-����������ܺ�=946kJ��mol-1+3��436 kJ��mol-1-6x=-92.2kJ��mol-1��x=391kJ��mol-1�����ƻ�1molN��H����Ҫ���յ�����Ϊ391kJ��
��4����֪��N2(g)+2O2(g)=2NO2(g) ��H1=+67.7kJ��mol-1����N2H4(g)+O2(g)=N2(g)+2H2O(g) ��H2=-534kJ��mol-1�����ݸ�˹�����ɢ���2-�ٿɵ�2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ��H=-1135.7kJ��mol-1��1molN2H4��NO2��ȫ��Ӧ���Ȼ�ѧ����ʽΪN2H4(g)+NO2(g)=N2(g)+2H2O(g) ��H=-567.85kJ��mol-1��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ï��[Fe(C5H5)2]���������ȼ�����Ӽ������͵Ŀ����������컯����Ҳ�������������ռ������ɻ����ϩ(![]() )��FeCl2�����Ұ�[(C2H5)3N]�����·�Ӧ�Ƶá�
)��FeCl2�����Ұ�[(C2H5)3N]�����·�Ӧ�Ƶá�
(1)��Ԫ�����ڱ��У���Fe��ͬ������ͬ���Ҽ۲��������Ϊ10��Ԫ����_____(��Ԫ�ط���)����Ԫ����̬ԭ�Ӻ���N����ӵ�����״̬_______(���ͬ�����෴��)��
(2)���Ұ��е縺����С��Ԫ����________(��Ԫ�ط���)��CԪ�ص�_______�ӻ������HԪ�ص�________����γ�_______����
(3)����״̬��Cl�У����������һ��������������������______(�����)��
A. [Ne]![]() B. [Ne]
B. [Ne] ![]()
C. [Ne] ![]() D. [Ne]
D. [Ne] ![]()
(4)��֪�������еĴ��������÷���![]() ��ʾ������m���������γɴ�������ԭ������n���������γɵĴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ
��ʾ������m���������γɴ�������ԭ������n���������γɵĴ������ĵ�����(�籽�����еĴ������ɱ�ʾΪ![]() )�������ϩ������(
)�������ϩ������(![]() )�еĴ�����Ӧ��ʾΪ________��
)�еĴ�����Ӧ��ʾΪ________��
(5)��ï���������ҿ������л��ܼ��У��侧������Ϊ________����ï���ľ����ṹ��ͼ��ʾ(δ������)���ܶ�Ϊpg��cm-3����һ��������Fe(C5H5)2����Ŀ�ļ������ʽΪ______(�谢���ӵ�������ֵΪNA)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.101kPaʱ��2H2(g)+O2(g)=2H2O(l) ��H=-572kJ��mol-1����H2��ȼ������H=-572 kJ��mol-1
B.500�桢30MPaʱ��������ӦN2(g)+3H2(g)![]() 2NH3(g) ��H=-38.6kJ��mol-1���ڴ������½�1.5mol H2����N2��ַ�Ӧ���ų�����19.3kJ
2NH3(g) ��H=-38.6kJ��mol-1���ڴ������½�1.5mol H2����N2��ַ�Ӧ���ų�����19.3kJ
C.�������������������������ֱ���ȫȼ�գ����߷ų�������
D.��֪��2C(s)+2O2(g)=2CO2(g) ��H1��2C(s)+O2(g)=2CO(g) ��H2������H1<��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
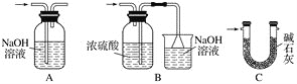
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʡ�����֮�������µķ�Ӧ��ϵ��
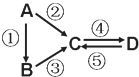
(1)��D���ʾ������ԣ��ڢ۷�Ӧ��Ҫ��ǿ����Һ���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���塣д���ڷ�Ӧ�����ӷ���ʽ_______________________________________���ܷ�Ӧ���ӷ���ʽ__________________________________________________��
(2)��A��Ӧ����㷺�Ľ������ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ֻ���ɫ���嵥�ʡ�д��A��ˮ�����·�Ӧ�Ļ�ѧ����ʽ_________________________________���ܷ�Ӧ�����ӷ���ʽ_________________________��D�м����������Ƶ�����_____________________��
(3)��A��̫���ܵ���õĹ�����ϣ�B�����������ߵ���ѧ���ģ�C��DΪ���Σ�C��ˮ��Һ�׳�ˮ������D����Һ�Լ��ԡ��ܷ�ӦҲ��ͨ��һ����������ЧӦ����Ҫ���塣д���۷�Ӧ�Ļ�ѧ����ʽ___________________________________���ݷ�Ӧ�õ�B����Ӧ����Ϊ���£���ݵĻ�ѧ����ʽΪ___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ��X��Y��Z��W�����ڱ��е�λ����ͼ��ʾ������WԪ�ص�ԭ���������������ڲ��������2��������˵����ȷ����
![]()
A.ԭ�Ӱ뾶��С��W>Y>Z
B.X���⻯����Z���⻯����Է�����Ӧ
C.�������Ӧˮ��������ԣ�Z>Y>W
D.�⻯����ȶ��ԣ�Y>Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
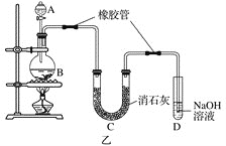
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3����SO2��ijС������ͼ��ʾװ�ý���ʵ��(�г�������A�еļ���װ�����ԣ��������Ѿ��������)ʵ�������ͼ��
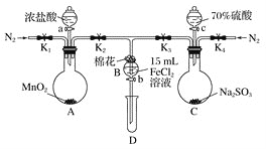
��.���ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�ε��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
��.����a���μ�һ������Ũ���ᣬ��A���ȡ�
��.��B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��.����b��ʹԼ2 mL����Һ����D�Թ��У��������е������ӡ�
��.���ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3��
��.�����Թ�D���ظ����̢�������B��Һ�е����ӡ�
(1)���̢��Ŀ����________________________��
(2)���н������ҺΪ__________________��������_______________________��
(3)A�з�����Ӧ�Ļ�ѧ����ʽ��______________________________________��
(4)���²��������Һ��Ƶ����ӷ�Ӧ��______________________________����______________(д�Լ���ѧʽ)�����������������___________________________��
(5)��˵��������Fe3����SO2�����ӷ���ʽ��__________________________��
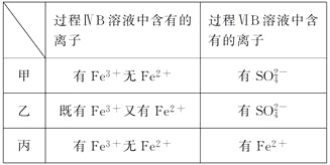
(6)�ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������Cl2��Fe3����SO2����________________(��ס����ҡ�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ᶼ����Ҫ�Ĺ�ҵԭ�ϡ�
��1����״���£���500 L��������ˮ�γ�1 L��ˮ����˰�ˮ�����ʵ���Ũ��Ϊ__mol�� L-1��������λ��Ч���֣�����ҵ�ϳ��ù�����ˮ���ն������÷�Ӧ�Ļ�ѧ����ʽΪ__��
��2�����������ǹ�ҵ�����кϳ��������Ҫ;�����ϳɵĵ�һ���ǽ����Ϳ����Ļ����ͨ�����ȵIJ���Ͻ������ںϽ����Ĵ��£�����������һ���������÷�Ӧ�Ļ�ѧ����ʽΪ__��
���з�Ӧ�еİ��백�������еİ�������ͬ����__��
A��2Na+2NH3===2NaNH2+H2�� B��2NH3+3CuO===3Cu+N2+3H2O
C��4NH3+6NO===5N2+6H2O D��HNO3+NH3===NH4NO3
��ҵ�е�β��������ֻ��NO��NO2�����ռ�������գ���Ӧ�����ӷ���ʽΪ2NO2+2OH��===NO2-+NO3-+H2O��NO+NO2+2OH��===������+H2O����ƽ�÷���ʽ����______________
��3����27.2 g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡHNO3500 mL����Ӧ�����в���������ֻ��NO��������ȫ�ܽ����������Һ������������ֻ��Cu2+���м���1 L 1 mol��L-1��NaOH��Һʹ��������ǡ����ȫ��������ʱ��Һ�����ԣ����ó�������Ϊ39.2 g��
��Cu��ϡHNO3��Ӧ�����ӷ���ʽΪ__��
��Cu��Cu2O �����ʵ���֮��Ϊ__��
��HNO3�����ʵ���Ũ��Ϊ__mol��L-1��
��4����H2SO4��HNO3�Ļ����Һ20 mL������0.25 molL��1Ba��OH��2��Һʱ�����ɳ���������w��g����Ba��OH��2��Һ�����V��mL���Ĺ�ϵ��ͼ��ʾ��C ����Һ�����ԣ�����ԭ���Һ��H2SO4�����ʵ���Ũ��Ϊ__mol��L-1��HNO3�����ʵ���Ũ��Ϊ__mol��L-1��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס���ʵ��С���������ʵ��װ�÷ֱ��Ʊ�SnCl4��Ư�ۡ�
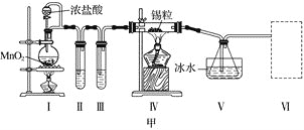
(1)��֪��a.�������۵�231 �棬��ѧ�������������ƣ�
b����������������ڽ�������Ӧ����SnCl4��SnCl4�ķе�114 ����
c��SnCl2��SnCl4����ˮ�⣬�������л��ܼ�����Sn2���ױ�����������ͼ��װ�ûش�
���Թܢ��е��Լ���____________________�����е��Լ���________________________��
�ڢ���װ�����ѡ��________(����ĸ)��
�ۢ�װ���з�Ӧ�����ӷ���ʽ��____________________________________________��
��ʵ�����������������װ�â���δ��Ӧ���MnO2����Ҫ�IJ���������______________��
(2)��֪����Cl2�볱ʪ����ʯ�ҷ�Ӧ�Ƿ��ȷ�Ӧ�����¶Ƚϸ�ʱCl2�볱ʪCa(OH)2�ķ�ӦΪ6Cl2��6Ca(OH)2=Ca(ClO3)2��5CaCl2��6H2O��
����ͼ��װ�ûش𣺴�ʵ������Ca(ClO)2���ʽϵ͵�������
��________________________________________________________________________��
��________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں���ͭ��ʱ����NH4Cl��Һ��ȥͭ�����������ͭ�Ա㺸�ӣ��䷴ӦΪ��CuO��NH4Cl �� Cu��CuCl2��N2����H2O(δ��ƽ)������˵����ȷ����
A. ��Ӧ�б������ͱ���ԭ��Ԫ�طֱ�ΪCu��N
B. ��Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ3��2
C. ��Ӧ�в���0.2 mol����ʱ��ת��0.6 mol����
D. �÷�Ӧ�б���ԭ��CuOռ���뷴ӦCuO��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com