
【题目】二茂铁[Fe(C5H5)2]可用作火箭燃料添加剂、汽油的抗爆剂和橡胶的熟化剂,也可作紫外线吸收剂。可由环戊二烯(![]() )和FeCl2在三乙胺[(C2H5)3N]存在下反应制得。
)和FeCl2在三乙胺[(C2H5)3N]存在下反应制得。
(1)在元素周期表中,与Fe既同周期又同族且价层电子总数为10的元素是_____(填元素符号),该元索基态原子核外N层电子的自旋状态_______(填“相同”或“相反”)。
(2)三乙胺中电负性最小的元素是________(填元素符号);C元素的_______杂化轨道与H元素的________轨道形成_______键。
(3)下列状态的Cl中,电离最外层一个电子所需能量最大的是______(填序号)。
A. [Ne]![]() B. [Ne]
B. [Ne] ![]()
C. [Ne] ![]() D. [Ne]
D. [Ne] ![]()
(4)已知:分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成的大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成的大π键的电子数(如苯分子中的大π键可表示为![]() ),则环戊二烯负离子(
),则环戊二烯负离子(![]() )中的大π键应表示为________。
)中的大π键应表示为________。
(5)二茂铁易升华且可溶于有机溶剂中,其晶体类型为________,二茂铁的晶胞结构如图所示(未画出微粒),密度为pg·cm-3,则一个晶胞中Fe(C5H5)2。数目的计算表达式为______(设阿伏加德罗常数的值为NA)。

【答案】Ni 相反 H sp3 1s ![]() D
D ![]() 分子晶体
分子晶体 ![]()
【解析】
(1) Fe为第四周期第VIII族的元素,在元素周期表中,与Fe既同周期又同族的元素为钴镍两种元素,符合价层电子排布总数为10的元素是Ni,价层电子排布为3d84s2,,该元素基态原子核外电子排布为N层电子的自旋状态相反,故答案:Ni;相反;
(2) 三乙胺的化学式为(C2H5)3N,非金属性越小,电负性越小,所以三乙胺中电负性最小的元素是H;依据价层电子理论,三乙胺 (C2H5)3N中C元素的价层电子数为4,所以为sp3杂化,杂化轨道与H元素的1s轨道形成![]() 键,故答案:H;sp3;1s;
键,故答案:H;sp3;1s;![]() ;
;
(3)根据核外电子轨道排布图结合洪特规则可知:[Ne] ![]() 的结构最稳定,所以电离最外层一个电子所需能量最大,故答案D;
的结构最稳定,所以电离最外层一个电子所需能量最大,故答案D;
(4)环戊二烯负离子(![]() )的化学式为C5H6-,分子中的大π键是由每个H原子提供一个电子,每个C原子提供1个电子形成的,所以环戊二烯负离子(
)的化学式为C5H6-,分子中的大π键是由每个H原子提供一个电子,每个C原子提供1个电子形成的,所以环戊二烯负离子(![]() )中的大π键应表示为
)中的大π键应表示为![]() ,故答案:
,故答案:![]() ;
;
(5)根据二茂铁[Fe(C5H5)2]易升华且可溶于有机溶剂的性质,可以推测二茂铁晶体类型为分子晶体;设一个晶胞中Fe(C5H5)2数目为n,根据二茂铁的晶胞结构图所示,根据密度公式![]() =
=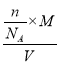 =
= =p,解得n=
=p,解得n=![]() ,故答案:分子晶体;n=
,故答案:分子晶体;n=![]() 。
。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) △H<0,下列研究目的和示意图相符的是( )
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响 (p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各化学键如图所示,下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
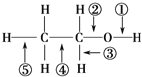
A.与金属钠反应时,键①断裂
B.在Cu催化下与![]() 反应时,键①、③断裂
反应时,键①、③断裂
C.与乙酸、浓硫酸共热发生酯化反应时,键①断裂
D.与乙酸、浓硫酸共热发生酯化反应时,键②断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、V(钒)五种元素形成的某分子结构如图所示,下列说法错误是
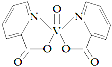
A.N原子核外存在3种不同能量的电子
B.基态V原子的价电子轨道表示式为![]()
C.基态O原子,电子占据的最高能级符号为2p
D.基态C、N两种原子中,核外存在相同对数自旋方向相反的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)
A. B.
B.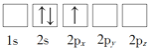
C.![]() D.
D.![]()
(2)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___________,中心原子的杂化形式为___________,LiAlH4中存在___________(填标号)
A.离子键 B.σ键 C.π键 D.氢键
(3)基态K原子中,核外电子占据最高能层的符号是___________,占据该能层电子的电子云轮廓图形状是____________;K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔沸点等都比Cr低,原因是___________
(4)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_____________、_____________
(5)气态三氧化硫以单分子形式存在,其分子的立体构型为_________,其中共价键的类型有____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:
A________、B________、C________、D________。
(2)E在元素周期表中的位置:_________________________________________________。
(3)F离子结构示意图:_____________________________________________________。
(4)A、B组成的最简单化合物的名称是____________________________________________。
(5)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为___________________________________________________________。
(6)能说明E的非金属性比F的非金属性____(填“强”或“弱”)的事实是________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn、Fe均为第4周期过渡金属元素,两元素的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能/(kJ·mol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
回答下列问题:
(1)Mn元素基态原子价电子层的电子排布式为__;比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是__。
(2)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为__,Fe原子配位数之比为__。
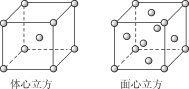
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。在压强为30MPa时,不同温度时合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据图中所示,合成氨的热化学方程式为___。
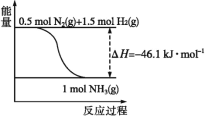
(2)将1molN2(g)和3molH2(g)通入一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“大于”“等于”或“小于”),原因是___;若加入催化剂,ΔH___(填“变大”“变小”或“不变”)。
(3)已知破坏1molN≡N键、1molH—H键需要吸收的能量分别为946kJ、436kJ,则破坏1molN—H键需要吸收的能量为___kJ。
(4)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,以NO2为氧化剂发生反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1。
则1molN2H4与NO2完全反应的热化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com