
【题目】微波炉加热时,电炉内的微波场以极高的频率改变电场的方向,使水分子迅速摆动而产生热效应。在高频改变方向的电场中水分子会迅速摆动的原因是( )
A. 水分子具有极性共价键 B. 水分子中有共用电子对
C. 水由氢、氧两种元素组成 D. 水分子是极性分子
科目:高中化学 来源: 题型:
【题目】对某一可逆反应:A+B ![]() 2C达到化学平衡,下列说法正确的是( )
2C达到化学平衡,下列说法正确的是( )
A. 增加A的量,化学平衡向右移动 B. 温度升高,化学平衡一定会发生移动
C. 增大压强,缩小容器体积,化学平衡不移动 D. 添加MnO2,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ③能与水在一定条件下反应生成有机物C |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③在Cu作催化剂且加热条件下能与O2反应 |
D | ①由C、H、O三种元素组成;②球棍模型为 ③能与C反应生成相对分子质量为100的酯 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是________________。
(2)写出在一定条件下,A发生聚合反应生成高分子化合物的化学方程式:_____________。
(3)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色。
(4)由B制备硝基苯的化学方程式___________________________。
(5)C在铜作催化剂且加热条件下能与氧气反应的化学方程式_________________。
(6)D中官能团的名称为__________________________。
(7)D与C反应能生成相对分子质量为100的酯,该反应的反应类型为____________;其化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度、压强和钒催化剂存在的条件下,SO2被空气中的O2氧化为SO3。V2O5是钒催化剂的活性成分,郭汗贤等提出:V2O5在对反应I的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如图1:
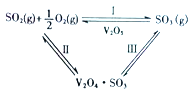
图1
(1)①已知有关气体分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | O=O(O2) | S=O(SO3) |
能量/kJ | 535 | 496 | 472 |
由此计算反应Ⅰ的△H=_________kJ·mol-1。
②写出反应Ⅱ的化学方程式_________。
(2)不能说明反应Ⅰ达到平衡状态的是_________。
A.恒容密闭容器中混合气体的压强不再变化
B.恒容密团容器中混合气体的密度不再变化
C.混合气体的总物质的量不再变化
D.混合气体的平均相对分子质量不再变化
E.n(SO2)∶n(O2)∶n(SO3)=2∶1∶2
F.SO2气体的百分含量不再变化
(3)在保持体系总压为105Pa的条件下进行反应SO2+1/2O2![]() SO3,原料气中SO2和O2的物质的量之比m(m=
SO3,原料气中SO2和O2的物质的量之比m(m=![]() )不同时,SO2的平衡转化率与温度(t)的关系如下图所示:
)不同时,SO2的平衡转化率与温度(t)的关系如下图所示:
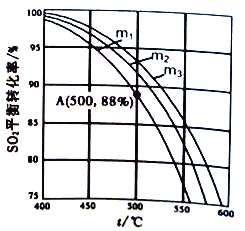
①图中m1、m2、m3的大小顺序为_________,理由是_________。
②反应I的化学平衡常数Kp表达式为_________(用平衡分压代替平衡浓度表示)。图中A点原料气的成分是:n(SO2)=10mol,n(O2)=24.4mol,n(N2)=70mol,达平衡时SO2的分压p(SO2)为_________Pa。(分压=总压×物质的量分数)。
③近年,有人研发出用氧气代替空气的新工艺,使SO2趋于全部转化。此工艺的优点除了能充分利用含硫的原料外,主要还有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
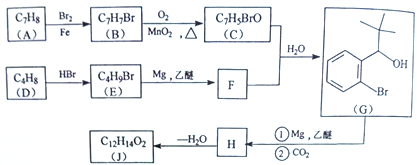
己知: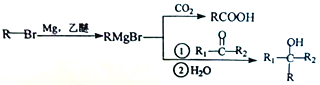
(1)G中官能团的名称为_________、_________。
(2)D的系统命名是_________。
(3)由A生成B的化学方程式为_________,反应类型_________。
(4)C与银氨溶液反应的化学方程式为________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_________。
(6)写出一种同时满足下面条件的G的同分异构体的结构简式_________。
①核磁共振氢谱有4组峰②能与FeCl3溶液发生显色反应
(7)借助题中信息写出以乙醛和苯为原料,合成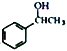 的路线流程图(其它试剂自选)。_________________________________________________________。
的路线流程图(其它试剂自选)。_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨有“光明使者”的美誉,在自然界中主要以钨(+6价)酸盐的形式存在,黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe、Mn)WO4,钨酸(B)酸性很弱,难溶于水,黑钨矿传统冶炼工艺的第一阶段是碱熔法,第二阶段则是用还原剂还原出金属钨。化合物A、B、C含有同一元素。请回答下列问题:
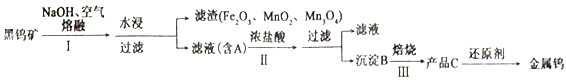
(1)为提高水浸速率,采取的措施为___________________(写两种)。
(2)用还原剂还原出金属钨。
①碳和氢气均可还原化合物C得钨,用氢气比用碳更具有优点,其理由是___________。
②如果用金属铝与化合物C反应,还原出1mol钨至少需要铝的质量为___________。
(3)利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)![]() WI2(g) △H<0。
WI2(g) △H<0。
①一定温度下,向某恒容密闭容器中加入2molI2(g)和足量W(s)达平衡后,I2(g)的转化率为20%,则平衡时c[I2(g)]∶c[WI2(g)]=___________;相同条件下,若开始加入I2(g)的物质的量变为原来2倍,则下列数值是原来2倍的有___________(填标号)。
A.平衡常数 B.达到平衡的时间
C.I2(g)的物质的量浓度 D.平衡时WI2(g)的体积分数
②工业上利用上述反应原理提纯金属钨的示意图如右:
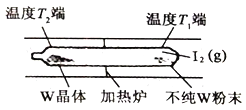
反应在真空石英管中进行,先在温度为T1端放入不纯W粉末和少量I2(g),一段时间后,在温度为T2的一端得到纯净的晶体,则温度T1___________T2(填:“>”、“<”或“=”)。
(4)写出黑钨矿中FeWO4在步骤Ⅰ中反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关试剂的保存正确的是
A.液氯通常保存在干燥的钢瓶中
B.金属钠通常保存在四氯化碳中
C.铁片通常保存在无色细口瓶中
D.硅酸钠溶液通常保存在磨口玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一:FeO(s)+CO(g) ![]() Fe(s)+CO2(g)(正反应吸热),其平衡常数可表示为
Fe(s)+CO2(g)(正反应吸热),其平衡常数可表示为![]() , 已知1100℃,K=0.263
, 已知1100℃,K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值__________(“增大”“减小”或“不变”),平衡常数K值__________(“增大”“减小”或“不变”)。
(2)1100 ℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,在这种情况下,该反应是否处于平衡状态__________(填“是”或“否”),此时,化学反应速率v正__________v逆(填“大于”“小于”或“等于”),其原因是_______________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com