
【题目】钨有“光明使者”的美誉,在自然界中主要以钨(+6价)酸盐的形式存在,黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe、Mn)WO4,钨酸(B)酸性很弱,难溶于水,黑钨矿传统冶炼工艺的第一阶段是碱熔法,第二阶段则是用还原剂还原出金属钨。化合物A、B、C含有同一元素。请回答下列问题:
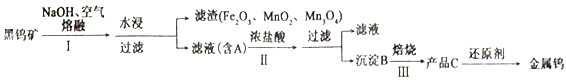
(1)为提高水浸速率,采取的措施为___________________(写两种)。
(2)用还原剂还原出金属钨。
①碳和氢气均可还原化合物C得钨,用氢气比用碳更具有优点,其理由是___________。
②如果用金属铝与化合物C反应,还原出1mol钨至少需要铝的质量为___________。
(3)利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)![]() WI2(g) △H<0。
WI2(g) △H<0。
①一定温度下,向某恒容密闭容器中加入2molI2(g)和足量W(s)达平衡后,I2(g)的转化率为20%,则平衡时c[I2(g)]∶c[WI2(g)]=___________;相同条件下,若开始加入I2(g)的物质的量变为原来2倍,则下列数值是原来2倍的有___________(填标号)。
A.平衡常数 B.达到平衡的时间
C.I2(g)的物质的量浓度 D.平衡时WI2(g)的体积分数
②工业上利用上述反应原理提纯金属钨的示意图如右:
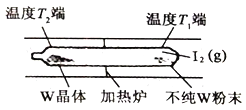
反应在真空石英管中进行,先在温度为T1端放入不纯W粉末和少量I2(g),一段时间后,在温度为T2的一端得到纯净的晶体,则温度T1___________T2(填:“>”、“<”或“=”)。
(4)写出黑钨矿中FeWO4在步骤Ⅰ中反应的化学方程式__________________________。
【答案】 粉碎、搅拌、升高水温等中的两种即可 氢气易与产物钨分离且不产生有毒气体 54g 4∶1 C < 4FeWO4+8NaOH+O2![]() 2Fe2O3+4Na2WO4+4H2O
2Fe2O3+4Na2WO4+4H2O
【解析】(1)粉碎、搅拌、升温等方法都可以达到目的;正确答案:粉碎、搅拌、升高水温等中的两种即可;
(2)①氢气的氧化产物为水,对环境无危害,且气体易与固体分离;而碳的氧化产物易产生一氧化碳,对环境有危害;正确答案:氢气易与产物钨分离且不产生有毒气体;
② 根据电子守恒规律:设消耗金属铝xmol,钨由+6价降到0价。铝由0价升高到+3价;
3×x=6×1,x=2mol,m(Al)= 2×27=54g, 正确答案:54g;
(3)① W(s) + I2(g)![]() WI2(g) △H<0。
WI2(g) △H<0。
起始量 2 0
变化量 2×20% 2×20%
平衡量 1.6 0.4
则平衡时c(I2(g))∶c(WI2(g))=4:1 ;
平衡常数为温度的函数,温度不变,平衡常数不变,A错误;增大反应物的浓度,反应速率加快,但不是成正比关系,B错误;该反应为反应前后气体的总量不变的反应,I2(g)的物质的量浓度增大2倍,相当于加压,平衡不动,平衡时I2(g)的物质的量浓度是原平衡的2倍,平衡时WI2(g)的体积分数保持不变;C正确,D错误;正确答案:4∶1 ;C;
② 碘单质受热易升华,温度升高,碘固体变为碘蒸气,从固体中分离;所以温度T1小于T2; 正确答案:<;
(4)黑钨矿在氢氧化钠、空气的条件下,高温发生反应,+2价铁变为+3价(氧化铁),发生氧化反应,氧由0价降低到-2价,发生还原反应,然后根据电子得失守恒进行配平,正确答案: 4FeWO4+8NaOH+O2![]() 2Fe2O3+4Na2WO4+4H2O;
2Fe2O3+4Na2WO4+4H2O;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】可充电氟镁动力电池比锂电池具有更高的能量密度和安全性,在充电和放电时,其电池反应为Mg+2MnF3![]() 2MnF2+MgF2。下列说法不正确的是( )
2MnF2+MgF2。下列说法不正确的是( )
A. 放电时,镁为负极材料
B. 放电时,电子从镁极流出,经电解质流向正极
C. 充电时,阳极的电极反应式为:MnF2+F--e-=MnF3
D. 充电时,外加直流电源负极应与原电池的Mg极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元索的单质和化合物在生产生活中有重要的用途。
(1)基态溴原子的核外电子排布式为[Ar]_________。
(2)在一定浓度的HF溶液中,氟化氢是以缔合形式(HF)2存在的。使氟化氢分子缔合的作用力是_________。
(3)HIO3的酸性_________(填“强于”或“弱于”)HIO4,原因是_________。
(4)ClO2-中心氯原子的杂化类型为_________,ClO3-的空间构型为_________。
(5)晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。下图是CaF2的晶胞,其中原子坐标参数A处为(0,0,0);B处为(![]() ,
, ![]() ,0);C处为(1,1,1)。则D处微粒的坐标参数为_________。
,0);C处为(1,1,1)。则D处微粒的坐标参数为_________。
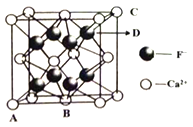
②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3,则晶胞中Ca2+与离它最近的F-之间的距离为_________nm(设NA为阿伏加德罗常数的值,用含C、NA的式子表示;相对原子质量:Ca 40 F 19)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微波炉加热时,电炉内的微波场以极高的频率改变电场的方向,使水分子迅速摆动而产生热效应。在高频改变方向的电场中水分子会迅速摆动的原因是( )
A. 水分子具有极性共价键 B. 水分子中有共用电子对
C. 水由氢、氧两种元素组成 D. 水分子是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请用下列4种物质的序号填空:①O2 ②NH4NO3 ③K2O2 ④NH3,既有离子键又有极性键的是___________。(填序号)
(2)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃(2.02×105 Pa),但在180 ℃就开始升华。据此判断,氯化铝是___________(填“共价化合物”或“离子化合物”),设计实验证明你的判断正确的实验依据是________________。
(3)现有a~g7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
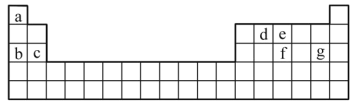
①元素的原子间反应最容易形成离子键的是___________。
A.c和f B.b和g C.d和g D.b和e
②d与g元素形成的分子中所有原子___________(填“是”或“不是”)都满足最外层为8电子结构。
(4)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素,已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又如A、C两元素原子序数之和是B、D两元素原子序数之和的1/2。请回答下列问题:
①写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:________,其晶体中所含化学键的类型有________。
②A2B与A2D的沸点:A2B________A2D(填“高于”或“低于”),其原因是____________。
③由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:____________________________。
④碳元素的一种同位素可测定文物年代,这种同位素的符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.标准状况下,1mol水的体积是22.4LB.1mol任何气体,体积均为22.4L
C.1molO2在标准状况下的体积约为22.4LD.标准状况下,气体的摩尔体积是22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com