
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
①46 g NO2和N2O4混合气体中含有的原子数为3NA
②标准状况下22.4L H2中含有的中子数为2NA
③1L 1mol/L的醋酸溶液中含有的离子总数为2NA
④1mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA电子
⑤9 g重水(D2O)所含有的电子数为5NA
⑥1L 1mol/L的MgCl2溶液中含有的离子数为2NA
⑦7.1 g氯气与足量NaOH溶液反应,转移的电子数为0.2NA
⑧1mol C10H22分子中共价键总数为31NA
⑨2L 3mol/L的Na2CO3溶液中含CO![]() 的数目为6NA
的数目为6NA
⑩1.8 g NH![]() 中含有的电子数为NA
中含有的电子数为NA
A.①③⑥⑨⑩ B.②④⑤⑥ C.①④⑧⑩ D.④⑥⑦⑧⑩
【答案】C
【解析】
试题解析:①把N2O4看作是NO2,46g气体中原子物质的量为46×3/46mol=3mol,故正确;② H2中不含中子数,中子数为0,故错误;③醋酸是弱酸,不能完全电离,离子总物质的量小于1mol,故错误;④无论生成氧化镁还是氮化镁,1molMg失去电子的物质的量为2mol,故正确;⑤质量数=核素的近似相对原子量,D2O的相对原子量为20,因此所含电子的物质的量为9×10/20mol=4.5mol,故错误;⑥溶液中含有水,水能电离出H+和OH-,溶液中离子物质的量大于3mol,故错误;⑦Cl2+2NaOH=NaCl+NaClO+H2O,因此7.1gCl2参加反应转移电子物质的量为7.1/71mol=0.1mol,故错误;⑧该有机物为烷烃,含有共价键的物质的量为31mol,故正确;⑨CO32-+H2O![]() HCO3-+OH-,CO32-的物质的量小于6mol,故错误;⑩含有电子的物质的量为1.8×10/18mol=1mol,故正确;综上所述,故选项C正确。
HCO3-+OH-,CO32-的物质的量小于6mol,故错误;⑩含有电子的物质的量为1.8×10/18mol=1mol,故正确;综上所述,故选项C正确。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效减碳的手段之一是节能,下列制氢方法最节能的是 。
A.电解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O![]() CO+3H2
CO+3H2
(2)CO2可转化成有机物实现碳循环。在体积为1 L 的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
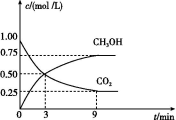
从3 min到9 min,v(H2)= mol/(L·min)。
②能说明上述反应达到平衡状态的是 (填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×1 | 2.4×1 | 1×1 |
下列说法正确的是 。
A.该反应正反应是放热反应
B.该反应在升高温度时,CH3OH(g)的体积分数减小,说明v正(CH3OH)减小,v逆(CH3OH)增大
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 Mpa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是(设NA表示阿伏伽德罗常数)
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝膜的熔点高于铝
B.向氢氧化镁悬浊液中加入浓的NH4Cl溶液,因发生化学反应而溶解
C.足量的Cu与含2molH2SO4的浓硫酸充分反应可生成NA个SO2分子
D.氢氧化铝溶于强碱溶液,说明铝具有一定的非金属性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的叙述中不正确的是
A. 原电池是将化学能转化为电能的装置
B. 在原电池中,电子流出的一极是负极,发生氧化反应
C. 锌、铜、硫酸组成的原电池中,溶液中的 Zn2+、 H+均向正极移动
D. 构成原电池的两个电极必须是活泼性不同的两种金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面六个图中,横坐标为某溶液中加入某物质的量,纵坐标为生成沉淀的量。从A—F中选择符合表中各题要求的序号填入表中:
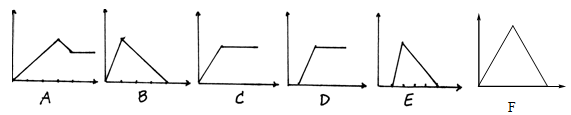
溶 液 | 加入的物质 | 答案序号 |
⑴饱和石灰水 | CO2 | |
⑵AlCl3溶液 | 过量NH3 | |
⑶含少量NaOH的NaAlO2 | 过量CO2 | |
⑷含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | |
⑸MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | |
⑹NaOH溶液 | 逐滴加AlCl3至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中不正确的是( )
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为![]() ×100%
×100%
C. 20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )
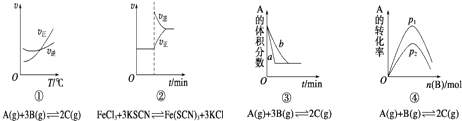
A.①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象
C.③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应不能实现的是( )
A.S→SO3→H2SO4→SO2
B.N2→NO→NO2→HNO3
C.Na→Na2O→NaOH→Na2CO3
D.Al→Al2O3→Al2(SO4)3→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题12分)可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
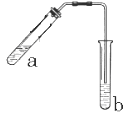
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序是:____________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_________。
(3)实验中加热试管a的目的是:________;_________。
(4)试管b中加有饱和Na2CO3溶液,其作用是___________。
(5)反应结束后,振荡试管b,静置。反应结束后,试管B内的液体分成两层,乙酸乙酯在___层(填写“上”或“下”)。若分离10mL该液体混合物需要用到的主要玻璃仪器是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com