
【题目】(本题12分)可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:
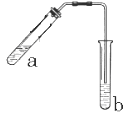
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序是:____________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_________。
(3)实验中加热试管a的目的是:________;_________。
(4)试管b中加有饱和Na2CO3溶液,其作用是___________。
(5)反应结束后,振荡试管b,静置。反应结束后,试管B内的液体分成两层,乙酸乙酯在___层(填写“上”或“下”)。若分离10mL该液体混合物需要用到的主要玻璃仪器是_____。
【答案】(1)先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸;(2)在试管a中加入几粒沸石(或碎瓷片);(3)①加快反应速率;②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动;(4)吸收随乙酸乙酯蒸出的少量酸性物质和乙醇;(5)上;分液漏斗。
【解析】
试题分析:(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸,故答案为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸;(2)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,故答案为:在试管a中加入几粒沸石(或碎瓷片);(3)实验中加热试管,反应的温度高,反应速度快,该反应为可逆反应,温度高,乙酸乙酯的沸点低,易挥发,所以化学平衡向正反应方向移动,利于生成乙酸乙酯。故答案为:①加快反应速率;②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动;(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,故答案为:吸收随乙酸乙酯蒸出的少量酸性物质和乙醇;(5)反应结束后,振荡试管b,静置。反应结束后,试管B内的液体分成两层,乙酸乙酯密度比水小在上层。分离互不相溶的两层液体混合物,需要用到的主要玻璃仪器是分液漏斗。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
①46 g NO2和N2O4混合气体中含有的原子数为3NA
②标准状况下22.4L H2中含有的中子数为2NA
③1L 1mol/L的醋酸溶液中含有的离子总数为2NA
④1mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA电子
⑤9 g重水(D2O)所含有的电子数为5NA
⑥1L 1mol/L的MgCl2溶液中含有的离子数为2NA
⑦7.1 g氯气与足量NaOH溶液反应,转移的电子数为0.2NA
⑧1mol C10H22分子中共价键总数为31NA
⑨2L 3mol/L的Na2CO3溶液中含CO![]() 的数目为6NA
的数目为6NA
⑩1.8 g NH![]() 中含有的电子数为NA
中含有的电子数为NA
A.①③⑥⑨⑩ B.②④⑤⑥ C.①④⑧⑩ D.④⑥⑦⑧⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,

判断下列叙述中正确的是
A. 每生成2分子AB吸收bkJ热量
B. 该反应热△H=+(a-b)kJ·mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA—A和1molB—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:

(1)A中制取C12反应的离子方程式是___________________。
(2)B装置中浓硫酸的作用是______________。
(3)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_____________。
(4)E装置的作用是______________(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断该溶液呈中性的依据是:
A.a=b
B.混合溶液的PH值为7
C.混合溶液中,![]()
D.混合溶液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组同学设计了如下图所示的实验装置。

(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。在此实验中,F仪器的作用是:______________;发生装置B应选择三种装置中的___________(填序号)。
(2)D装置中主要反应的离子方程式为__________________。
(3)为验证通入D装置中过量的气体是Cl2还是SO2气体,兴趣小组的同学准备了以下试剂:①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液 ⑤酸性高锰酸钾溶液。
A.若Cl2过量:取适量D中溶液滴加至盛有______(选填一个序号)试剂的试管内,再加入_____(选填一个序号)试剂,发生的现象是:____________________;
B.若SO2过量:取适量D中溶液滴加至盛有______(选填一个序号)试剂的试管内,发生的现象是:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列应用和相应原理(用化学方程式表示)及基本反应类型都正确的是( )
A.用纯碱制烧碱 2KOH+Na2CO3=K2CO3+2NaOH 复分解反应
B.我国古代的“湿法炼铜”:2Fe+3CuSO4=3Cu+Fe2(SO4)3 置换反应
C.用天然气作燃料 CH4+2O2![]() CO2+2H2O 氧化还原反应
CO2+2H2O 氧化还原反应
D.证明金属镁的活动性比铁强:3Mg+2Fe(OH)3=3Mg(OH)2+2Fe 置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com