
【题目】苯胺为无色液体,还原性强,易被氧化;有碱性,与酸反应生成盐。常用硝基苯与H2制备:
![]() +3H2
+3H2![]()
![]() +2H2O。
+2H2O。
其部分装置及有关数据如下:
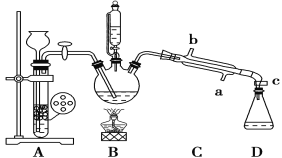
项目 | 沸点/℃ | 密度(g/mL) | 溶解性 |
硝基苯 | 210.9 | 1.20 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚 |
乙醚 | 34.6 | 0.71 | 不溶于水,易溶于硝基苯、苯胺 |
实验步骤:
①检查装置的气密性,连接好C处冷凝装置的冷水。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压分液漏斗,换上温度计。
③打开装置A、B间活塞,通入H2一段时间。
④点燃B处的酒精灯,加热,使温度维持在140℃进行反应。
⑤反应结束后,关闭装置A、B间活塞,加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186 ℃馏分,得到较纯苯胺。
回答下列问题:
(1)步骤⑥中温度计水银球的位置在________。
(2)下列关于实验的叙述中,错误的是________。
A.冷凝管的冷水应该从b进从a出
B.实验开始时,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置A中应使用锌粉,有利于加快生成H2的速率
D.加入沸石的目的是防止暴沸
(3)若实验中步骤③和④的顺序颠倒,则实验中可能产生的后果是_______。
(4)蒸馏前,步骤⑤中加入生石灰的作用是_______。
(5)有学生质疑反应完成后,直接蒸馏得到苯胺的纯度不高,提出以下流程:
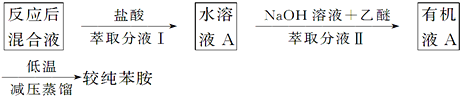
苯胺在酸性条件下生成盐酸苯胺被水萃取,在碱性溶液中又被放有机溶剂反萃取,这种萃取——反萃取法简称反萃。实验中反萃的作用是___;在分液漏斗中进行萃取分液时,应注意不时放气,其目的是____。
【答案】三颈烧瓶出气口(等高线)附近 AC 加热时氢气遇氧气发生爆炸;生成的苯胺被氧气氧化 除去反应中生成的水 除去苯胺中较多的杂质,有利于蒸馏提纯 降低漏斗内的压力,使漏斗内外压强一致
【解析】
(1)收集182~186℃馏分,得到较纯苯胺,反应时温度计测量的是苯胺蒸汽的温度,所以温度计的水银球应该放在三颈烧瓶出气口(等高线)附近;
(2)冷凝管,为了充分冷却,水从下口进,从上口出;实验开始时,溶液反应温度为140℃,A为制取氢气的简易装置,不能用锌粉,否则下无法控制反应;沸石的结构能防止暴沸;
(3)苯胺为无色液体,还原性强,易被氧化,制备装置中需排尽空气,防止氧化,氢气氧气混合气体在加热的条件下易发生爆炸;
(4)反应结束后,关闭装置A、B间活塞,加入生石灰,生石灰能和水反应,不能和苯胺反应,所以蒸馏前加入生石灰,能除去反应中生成的水;
(5)萃取法是分离互溶的液体的方法,萃取反萃取法简称反萃,通过反萃能除去苯胺中较多的杂质,有利于蒸馏,在分液漏斗中进行萃取分液时,不时放气,减低漏斗内的压力,是漏斗内外压强一致,易于液体流出。
(1)步骤⑥中收集182~186℃馏分,得到较纯苯胺,反应时温度计需测量苯胺蒸气的温度,所以温度计的水银球应该放在三颈烧瓶出气口(等高线)附近;
(2)A.冷凝管水流遵循逆流原理,即冷水从冷凝管下口进入,上口流出,这样冷凝效果好,该实验冷凝管的冷水应该从a进从b出,A错误;
B.用硝基苯与H2制备苯胺,反应温度为:140℃,实验开始时,温度计水银球应插入反应液中,便于控制反应液的温度,B正确;
C.装置A为制取氢气的简易装置,使用锌粉,虽有利于加快生成H2的速率,但固液无法分离,无法控制反应速率,C错误;
D.沸石的多孔结构,液体变气体会逐步释放,防止突然迸发,所以沸石能防止暴沸,D正确;
故合理选项是AC;
(3)若实验中步骤③和④的顺序颠倒,则实验装置中的空气无法排除,加热时氢气遇氧气发生爆炸,苯胺为无色液体,还原性强,易被氧化,生成的苯胺被氧气氧化;
(4)生石灰为氧化钙能和水反应生成氢氧化钙,苯胺为无色液体,有碱性,与生石灰不反应,所以蒸馏前加入生石灰,能除去反应中生成的水;
(5)苯胺在酸性条件下生成盐酸苯胺被水萃取,去除了一部分不溶于酸的杂质,在碱性溶液中又被有机溶剂反萃取,又去除了一部分不溶于碱的杂质,实验中反萃能除去苯胺中较多的杂质,有利于蒸馏,在分液漏斗中进行萃取分液时,不时放气,减低漏斗内的压力,使漏斗内外压强一致,易于分液漏斗中液体流出。


科目:高中化学 来源: 题型:
【题目】下列四个数据都表示合成氨的反应速率,其中速率相等的是( )
①![]() (N2)=0.6mol/(L·min) ②
(N2)=0.6mol/(L·min) ②![]() (NH3)=1.8mol/(L·min)
(NH3)=1.8mol/(L·min)
③![]() (H2)=1.2mol/(L·min) ④
(H2)=1.2mol/(L·min) ④![]() (H2)=0.045mol/(L·s)
(H2)=0.045mol/(L·s)
A. ①②B. ①③C. ③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12)烷烃A只可能有三种一氯取代产物B、C和D。C的结构简式是 。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下所示。
。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下所示。

请回答下列问题:
(1)A的结构简式是_______________H的结构简式是________________
(2)B转化为F属于________反应,B转化为E的反应属于________反应(填反应类型名称)。
(3)写出F转化为G的化学方程式_____________ 。
(4)1.16 g H与足量NaHCO3作用,标准状况下可得CO2的体积是______mL。
(5)写出反应①的方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氯元素比硫元素非金属性强,某化学实验小组设计如下实验,请回答下列问题:

(1)A中药品足量,发生的化学反应方程式____,当生成2.24 L Cl2(标况)时,被氧化的浓盐酸的物质的量为____;
(2)B中试剂为_______,该装置的作用是_______;
(3)C中盛有硫化钾溶液,该装置的现象是______;
(4)在D的KI溶液中添加少量_____,通过观察到________的现象,可以证明氯元素的非金属性大于碘元素。指出整个实验设计的不足之处_____;
(5)请阅读下列信息:
①硫化氢的水溶液酸性比氯化氢的弱 ②S2Cl2分子中氯元素显-1价 ③铜和氯气在加热条件下反应生成氯化铜,铜和硫在加热条件下反应生成硫化亚铜 ④沸点:硫磺>氯气 ⑤高氯酸的酸性大于硫酸
能证明氯元素的非金属性比硫元素强的是______(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。已知:K1000℃>K800℃,则该反应是__反应。(填“吸热”或“放热”);
(2)已知在800℃时,该反应的平衡常数K1=0.9,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=___。
CO2(g)+H2(g)的平衡常数K2=___。
(3)能判断该反应是否达到化学平衡状态的依据是__。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为__℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液pH逐渐降低
C. K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的三个原电池装置,其中结论正确的是( )
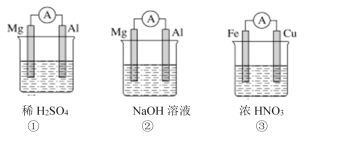
A.①②中Mg作负极
B.③中电流方向由Cu流向Fe
C.②中Mg作正极,电极反应式为2H2O+2e-=2OH-+H2↑
D.③中Cu作正极,电极反应式为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(气)+3B(气) ![]() 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是
A.C生成的速率与C分解的速率相等
B.A、B、C的浓度相等
C.A、B、C的分子数比为1:3:2
D.单位时间生成n mol A,同时生成3n mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2 是大气的主要污染物之一,某研究小组设计如图所示的装置对NO2 进行回收利用,装置中a、b均为多孔石墨电极。下列说法正确的是

A. a 为电池的负极,发生还原反应
B. 电子流向:a 电极→用电器→b 电极→溶液→a 电极
C. 一段时间后,b 极附近HNO3浓度增大
D. 电池总反应为4NO2 +O2 +2H2O= 4HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com