
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN3的质量分数。实验步骤如下:
①称取2.5000 g叠氮化钠试样,配成250 mL溶液。
②准确量取25.00 mL溶液置于锥形瓶中,用滴定管加入50.00 mL 0.1000 mol·L-1(NH4)2Ce(NO3)6(六硝酸铈铵)[发生反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5 mL浓硫酸,滴入2滴邻菲罗啉指示液,用0.0500 mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+===Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00 mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有________、________。

(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为____。
(3)若其他读数正确,滴定到终点后,读取滴定管中(NH4)2Fe(SO4)2标准溶液体积,按如图图示读取,将导致所测定样品中叠氮化钠质量分数________(选填:“偏大”、“偏小”或“不变”)
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)?
解析:本题考查了化学实验、化学计算以及实验误差分析等知识,意在考查考生的实验能力和应用能力。(2)叠氮化钠受撞击时分解,生成单质钠和氮气。(3)反应原理为:六硝酸铈铵过量,与叠氮化钠反应后,剩余的六硝酸铈铵与硫酸亚铁铵反应。按题图读数计算出的硫酸亚铁铵溶液的体积比实际用量大,计算出的与硫酸亚铁铵反应的六硝酸铈铵的量偏大,则计算出的与叠氮化钠反应的六硝酸铈铵的量偏小,导致所测定样品中叠氮化钠的质量分数偏小。
答案:(1)250 mL容量瓶(1分) 胶头滴管(1分)
(2)2NaN3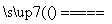 2Na+3N2↑(3分)
2Na+3N2↑(3分)
(3)偏小(2分)
(4)n[(NH4)2Ce(NO3)6]=0.1000 mol·L-1×50.00×10-3 L=5.000×10-3 mol n[(NH4)2Fe(SO4)2]=0.0500 mol·L-1×24.00×10-3 L=1.200×10-3 mol
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.000×10-3 mol-1.200×10-3 mol=3.800×10-3 mol
w=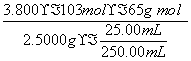 =0.9880(5分)
=0.9880(5分)


科目:高中化学 来源: 题型:
 某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0 g铝片放入圆底烧瓶中,然后通过分液漏斗加入500 mL 0.5 mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如右图所示) ,请你帮助该小组同学回答下列问题 :
某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0 g铝片放入圆底烧瓶中,然后通过分液漏斗加入500 mL 0.5 mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如右图所示) ,请你帮助该小组同学回答下列问题 :
(1)曲线OA段不产生氢气的原因是_____________ _ ______
____________________ _____,
有关的离子反应方程式为_________________________ _____ _____
(2)曲线BC段产生氢气的速率突然加快的主要原因是
____________________________________________________________________________
(3)点C以后产生氢气的速率逐渐减小的主要原因是
____________________________________________________________________________
(4)从理论上分析该小组同学能收集到氢气的体积为(标准状况下)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1 mol Na2O2固体中含有的O 数为2NA
数为2NA
B.常温常压下,3.2 g CH4中含有的电子数为2NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数为0.5NA
D.100 mL 1 mol·L-1的CH3COOH溶液中含有的CH3COOH分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A.10 g质量分数为46%的乙醇溶液中,氢原子的总数为1.2NA
B.5.6 g铁与足量硫加热充分反应转移电子数为0.2NA
C.50 mL 12 mol·L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3NA
D.标准状况下,含有1 mol硫原子的SO2与SO3的混合物,其体积小于22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,所含氯原子(包含氯离子)个数最多的是
A.448mL(标准状况)Cl2 B.0.5mol HCl
C.13.35g AlCl3 D.1L 0.5mol/L MgCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+ H2O(g) CO(g)+H2(g)在一固定容积的密闭容器中进行,下列条件的改变对其反应速率有影响的是
CO(g)+H2(g)在一固定容积的密闭容器中进行,下列条件的改变对其反应速率有影响的是
A.减少H2O的浓度 B.加入催化剂
C.增加C的用量 D.升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com