
【题目】I.(化学反应原理)
(1)在101kPa时,足量H2在1molO2中完全燃烧生成2mol液态水,放出571.6kJ的热量,H2的燃烧热△H=__。
(2)1.00L1.00mol·L-1硫酸与2.00L1.00mol·L-1NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为__。
II.(化学与生活)
保证食品安全、保持营养均衡,是保障人体健康的基础。
(1)维生素C能促进人体生长发育。下列富含维生素C的是___。
A.牛肉 B.辣椒 C.鸡蛋
(2)缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是__。
A.碘 B.铁 C.钙
【答案】-285.8 kJ /mol ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol B A
Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol B A
【解析】
I.(1)1mol纯物质完全燃烧生成稳定的氧化物时放出的热量为燃烧热;
(2)强酸强碱的稀溶液发生中和反应,生成1mol水时放出的热量为中和热。
II.(1)新鲜蔬菜和水果中富含维生素C;
(2)缺少碘元素会造成甲状腺肿大。
I.(1)足量H2在1molO2中完全燃烧生成2mol液态水,放出571.6kJ的热量,那么H2在0.5molO2中完全燃烧生成1mol液态水是放出的热量为285.8kJ,因此H2的燃烧热△H=-285.8 kJ /mol;
(2)1.00L1.00mol·L-1硫酸与2.00L1.00mol·L-1NaOH溶液完全反应,生成2molH2O时放出114.6kJ的热量,那么生成1molH2O时放出的热量为57.3kJ,因此中和热的热化学方程式为:
![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol。
Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol。
II.(1)新鲜蔬菜和水果中富含维生素C,因此富含维生素C的食物是辣椒;
(2)缺少碘元素会造成甲状腺肿大,因此该微量元素是碘。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】1丁醇CH3CH2CH2CH20H和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图,下列对该实验的描述错误的是

A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 1丁醇和乙酸能反应完或者有一种能消耗完
D. 加入过量乙酸可以提高1丁醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y、Z是原子序数依次增大的短周期主族元素,Q原子的最外层电子数是内层电子数的2倍,X、Y、Z在周期表中的位置关系如图所示。下列说法正确的是
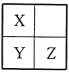
A. Q和Z可能形成化合物QZ2
B. Y的最高价氧化物的水化物一定是强酸
C. X、Z和氢三种元素不可能组成离子化合物
D. 最简单气态氢化物的沸点:Q>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。则下列说法正确的是( )

A. X与A反应的化学方程式是:Al2O3 + 2Fe ![]() Fe2O3 + 2Al
Fe2O3 + 2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体PCl5受热即挥发并发生分解:PCl5(g)![]() PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,求平衡时PCl5的分解率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(化学反应原理)
恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应到平衡状态,生成C的平均反应速率为___。
(2)该反应的化学平衡表达式为___。
(3)下列各项可作为该反应达到平衡状态的标志是___。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.A的消耗速率与B的消耗速率之比为2:1
II.(化学与生活)
有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是___(填序号)。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___(填序号)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)如何判断滴定达到终点__________________________ 。
(2)该小组在步骤①中的错误是_________________ ,由此造成的测定结果_____________(填偏高、偏低或无影响);
(3)步骤②缺少的操作是__________________________;
(4)如图,是某次滴定时滴定管中的液面,其读数为_____________ mL

(5)根据下列数据:
滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
滴定前读(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
第三次 | 25.00 | 0.80 | 23.10 |
请选用合理的数据计算待测烧碱溶液的浓度为_____________ mol/L(保留到小数点后四位)
(6)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定前读数正确,滴定结束时俯视读数:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据转化关系判断下列说法不正确的是( )
![]()
A.反应①中,(C6H10O5)n可表示淀粉或纤维素
B.反应②中,1mol葡萄糖可生成2mol乙醇
C.乙醇、乙酸和乙酸乙酯互为同系物
D.将铜丝在空气中灼烧后趁热插入乙醇中可得到乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢镍电池放电时的总反应为MH+NiOOH==M+Ni(OH)2。以氢镍电池为电源,能将废水中的CN-转化为CO32-和N2,该装置如图所示。下列说法不正确的是

A. 电极a为正极
B. 负极反应式为MH+OH--e-==H2O+M
C. 每消耗1 mol CN-,理论上导线中通过3 mo1 e-
D. 阴极区溶液的PH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com