
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)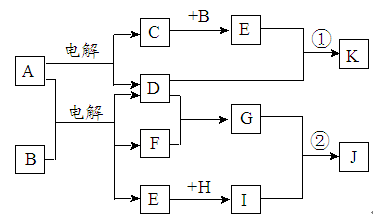
请回答下列问题:
(1)A的电子式为 。
(2)H的化学式为 。
(3)写出反应①的离子方程式 。
(4)写出反应②的化学方程式 。
(1)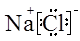 (1分)
(1分)
(2)SiO2(1分)
(3)Cl2 + 2OHˉ =" Clˉ+" ClOˉ + H2O(2分)
(4)Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl(2分)
解析试题分析:由题中信息得出,A为NaCl,B为H2O,F为H2,D为Cl2,H为SiO2,J为H2SiO3,C为Na,E为NaOH,G为HCl,I为Na2SiO3。
(1)NaCl的电子式为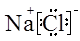 。
。
(2)H的化学式为SiO2。
(3)反应①是NaOH和Cl2的反应,离子方程式为Cl2 + 2OHˉ =" Clˉ+" ClOˉ + H2O。
(4)反应②是HCl和Na2SiO3的反应,离子方程式为Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl。
考点:无机物的推断 电子式的书写 离子方程式的书写 化学方程式的书写 电解原理


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:填空题
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。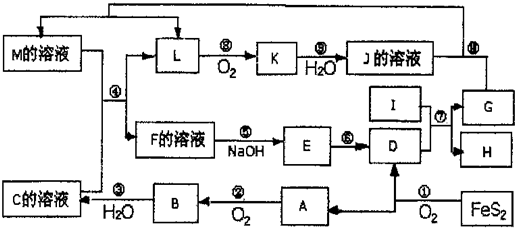
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法 。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是 。
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。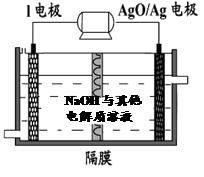
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题: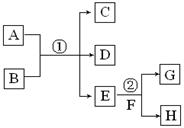
(1) 写出反应②的化学反应方程式 ,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是 。
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间。则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种无色的气体,且B遇盐酸产生无色无味的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水。则A过量时反应①的离子反应方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图表示常见元素单质及化合物相应转化关系,部分反应的产物没有全部列出。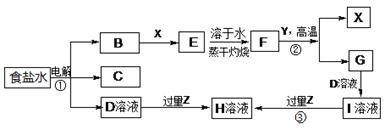
已知:B是一种黄绿色气体,C在所有气体中密度最小,D是一种碱;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料;Z为气态氧化物。
请回答下列问题:
(1)气体B具有 (填“还原性”、“氧化性”或“漂白性”),反应②属于四种基本反应类型反应中的 。
(2) 有学生认为B与X反应的产物E不一定是纯净物。他认为产物中可能还有 (填化学式),为验证其猜想该同学设计了相关实验,你认为他需要选择的试剂为 (填序号)。
a.酸性高锰酸钾溶液 b.NaOH溶液 c.KSCN溶液 d.稀硫酸
(3)若Z能导致温室效应,则反应③的离子反应方程式为 。
(4)若Z是我国酸雨形成的罪魁祸首,目前应用最广泛的工业处理含Z废气的方法是在一定条件下与生石灰作用而使其固定,产物可作建筑材料,反应的化学方程式为 。
(5)若Z是形成酸雨的另一种主要物质,Z与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),请写出该反应的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、 E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色:反应③中有水生成,反应②需要放电才能发生,A是—种极易溶于水的气体,A和D相遇有白烟生成。
(1)反应③的化学方程式为_______________________________________________。
(2)反应①中每生成1 molC,转移的电子数为_______________________________。
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈性___________(填“酸”“碱”或“中’’),该水溶液中存在着如下关系,用粒子浓度符号填写:
①c(H+)+_________=c(OH-)+_____________;
②c(H+)=c(OH-)+_____________。
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式____________________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流。则该新型电池的正极的电极反应式为___________________________;原电池的总反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D均为中学化学中的常见物质,请根据题中信息回答问题。
(1)已知它们存在如下反应转化关系:A +B→C +D(未配平,反应条件略去)。
①该转化关系中所涉及的反应为置换反应。若A是金属单质,D是非金属单质,且A 原子的质子数是D原子的2倍,则反应的方程式是 。
②该转化关系中所涉及的反应为非置换反应。若A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是 。
(2)已知它们存在如下反应转化关系:A +B→C +D+H2O(未配平,反应条件略去)。
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,当A的摩尔质量小于B时,物质B的名称为 ,鉴别C、D两种气体不能选用的试剂是 。
a.Ba(OH)2溶液
b.酸性KMnO4溶液
c.紫色石蕊试液
d.H2O2与BaCl2混合液
e.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C。当参加反应的A、B物质的量之比为3∶4时,则C与D物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X原子中没有中子,Y元素最高正价与最低负价之和为0;M与X同主族;Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) ,M离子的电子排布式为 。
由以上某些元素组成的化合物A、B、C、D有如下转化关系
其中C是溶于水显酸性的气体;D是淡黄色固体。
(3)写出C的结构式 ;D的电子式
(4)如果A、B均由三种元素组成,B为两性不溶物,写出由A转化为B的离子方程式
(5)如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 。
(6)如果将27题中A、B浓度均为0.1mol/L的溶液混合,混合溶液中离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。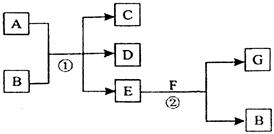
回答下列问题:
(1)A、G的化学式分别为___ 、___ 。
(2)A和E反应的化学方程式为__ 。
(3)写出反应①的化学方程式_____________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F _ ___g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题: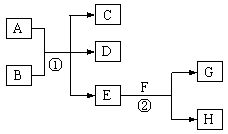
(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一 种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
( 4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4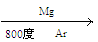 Ti
Ti
①C(s) + O2(g) = CO2(g); △H = -393.5 kJ?mol-1
②2CO(g) + O2(g) = 2CO2(g); △H = -566 kJ?mol-1
③TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g); △H =" +141" kJ?mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) 的△H = _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com