
【题目】25℃时,向20mL0.2mol·L-1NaCN溶液中加入0.2mol·L-1的盐酸,溶液pH随所加盐酸体积的变化如图所示(M>7)。下列说法不正确的是

A. 25℃时,K(HCN)≈10-9.4
B. b点时,c(CN-)<c(HCN)
C. c点时,c(Cl-)>c(H+)+c(HCN)
D. a、b、c三点时,水的电离程度:a>b>c
【答案】C
【解析】
A.25℃时,取图象中c点,此时溶液中c(HCN)≈0.1mol/L,c(H+)=10-5.2,故c(CN-)≈10-5.2mol/L,![]() ,A项正确;
,A项正确;
B.b点时,溶液呈碱性,CN-的水解大于HCN的电离,故c(CN-)<c(HCN),B项正确;
C.c点时,两者恰好完全反应,得到氯化钠和氢氰酸的混合溶液,据物料守恒有c(Cl-)=c(CN-)+c(HCN),而H+一部分由HCN电离出来,另一部分由H2O电离出来,所以c(H+)>c(CN-),故c(Cl-)<c(H+)+c(HCN),C项错误;
D.CN-促进水的电离,HCN抑制了水的电离,故a、b、c三点时,水的电离程度a>b>c,D项正确;
答案选择C项。


科目:高中化学 来源: 题型:
【题目】草酸钙晶体(CaC2O4·H2O)是一种受热容易分解的盐,某班同学要探究其受热分解的产物,甲组同学认为其分解产物可能是CaCO3、CO和H2O,乙组同学认为其分解产物可能是CaO、CO2和H2O。两组同学将草酸钙晶体放入石英试管进行加热,按照下图所示装置进行探究,请回答相关问题。
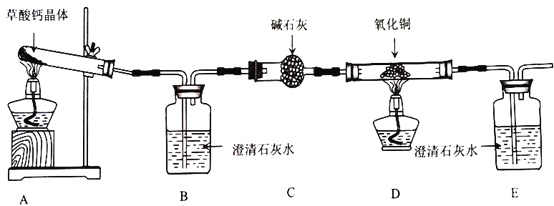
(1)盛放碱石灰的仪器名称是___________。证明分解产物中有CO的现象是______________________。
(2)装置存在一处明显缺陷,该缺陷是________________,改进的方法是______________________(任写一种)。
(3)实验中B中澄清石灰水未变浑浊,甲组同学认为自己的判断正确,但乙组同学认为可能是因为温度不够,需将试管下方酒精灯更换为___________重新实验。
(4)更换仪器及各种试剂后重新实验,B中澄清石灰水变浑浊,装置C的作用是______________________。
(5)更换仪器重新实验时发生的反应方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法均可制得氯气:
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A. 6∶5∶6B. 1∶3∶5C. 15∶5∶3D. 1∶6∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别由短周期元素m、n、p、q组成的单质依次为甲、乙、丙、丁,有关反应关系如图所示(部分产物省略)。其中甲为黄绿色气体,M、N均为10电子分子且M的水溶液呈碱性,Q为离子化合物,下列说法中正确的是

A. 原子半径的大小m>q>n>p
B. 元素非金属性q>n>p
C. Q的溶液可以保存在细口玻璃试剂瓶
D. n的氧化物的水化物一定为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空:
(1)4.5 g水与____ g 硫酸所含的分子数相等,它们所含氧原子数之比是____,氢原子数之比是____。
(2)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D,现将16 g A与70 g B的混合物充分反应后,生成2 mol D和一定量的C,则D的摩尔质量是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式符合CnH2n+2的不同物质一定互为同系物
B.分子式符合CnH2n的烃不一定是烯烃
C.烷烃、烯烃和炔烃都属于链状烃
D.芳香族化合物均具有香味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述不正确的是( )
A. pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO42-)与c(H+)之比约为1:10
B. Na2CO3、NaHCO3两种盐溶液中,离子种类相同
C. CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
D. 滴入酚酞,NaNO2溶液显红色,证明HNO2是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中烃的分子式排列规律,判断空格中的烃的同分异构体数目( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A. 2B. 3C. 4D. 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)![]() N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 0.100 | 0.076 | 0.060 | 0.060 | 0.050 | 0.050 |
N2 | 0 | 0.012 | 0.020 | 0.020 | 0.025 | 0.025 |
CO2 | 0 | 0.012 | 0.020 | 0.020 | 0.011 | 0.011 |
(1
(2)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com