
 NiOOH+MH(M表示储氢合金),下列叙述正确的是
NiOOH+MH(M表示储氢合金),下列叙述正确的是 科目:高中化学 来源: 题型:阅读理解

| 放电 |
| 充电 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
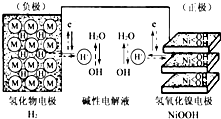 (2013?绍兴一模)航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应).白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电.下列说法正确的是( )
(2013?绍兴一模)航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应).白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 充电 |
| 放电 |
| ||
| 高温高压 |
| 时间/min | c(N2)/mol?L-1 | c(H2)/mol?L-1 | c(NH3)/mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化学 来源:广东省模拟题 题型:单选题
 NiOOH+MH (M表示储氢合金),下列叙述正确的是
NiOOH+MH (M表示储氢合金),下列叙述正确的是 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com