
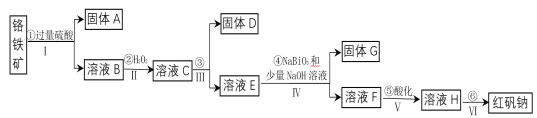
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42—,自身被还原为Bi(OH)3固体。
ii.
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
开始沉淀的PH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的PH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是___________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式________________。
(4)⑤中酸化是使CrO42—转化为Cr2O72—。写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200mL的稀硫酸中,向所得溶液中加入5.0mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。

【答案】增大反应物的接触面积,加快反应速率,提高浸出率 漏斗、烧杯 3NaBiO3+Cr2(SO4)3+7NaOH+H2O=2Na2CrO4+3Na2SO4+3Bi(OH)3 2CrO42—+2H+ ![]() Cr2O72—+H2O 冷却结晶 2.5mol·L-1 0.10mol
Cr2O72—+H2O 冷却结晶 2.5mol·L-1 0.10mol
【解析】
(1)根据影响反应速率的因素进行分析;
(2)操作I、III、IV均是过滤,根据过滤操作所需的仪器进行分析;
(3)NaBiO3有强氧化性,在碱性条件下,能将Cr3+转化为CrO![]() ,据此写出反应的化学方程式;
,据此写出反应的化学方程式;
(4)酸化是使CrO![]() 转化为Cr2O
转化为Cr2O![]() ,在转化过程中元素化合价不变;据此写出离子方程式;
,在转化过程中元素化合价不变;据此写出离子方程式;
(5)根据从溶液中得到晶体的一般操作进行分析;
(6)根据图像可知加入氢氧化钠时没有立即产生沉淀,这说明酸过量,首先发生酸碱中和;继续加入氢氧化钠溶液,沉淀逐渐增大,达到最大值,后氢氧化钠过量,沉淀部分溶解,说明沉淀为氢氧化铁和氢氧化铝;根据图像结合方程式和元素守恒进行分析计算。
(1)将铬铁矿石粉碎可以增大反应物的接触面积,加快反应速率,提高浸出率;
故答案为:增大反应物的接触面积,加快反应速率,提高浸出率;
(2)操作I、III、IV均是过滤,则用到的主要玻璃仪器有玻璃棒和漏斗、烧杯;
故答案为:漏斗、烧杯;
(3)常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO![]() ,则反应④的化学方程式为3NaBiO3 +Cr2(SO4)3+7OH-+H2O=Na2CrO4+3Na2SO4+3Bi(OH)3↓;
,则反应④的化学方程式为3NaBiO3 +Cr2(SO4)3+7OH-+H2O=Na2CrO4+3Na2SO4+3Bi(OH)3↓;
故答案为:3NaBiO3+Cr2(SO4)3+7NaOH+H2O=2Na2CrO4+3Na2SO4+3Bi(OH)3↓;
(4)⑤中酸化是使CrO42-转化为Cr2O72-,在转化过程中元素化合价不变,则该反应的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(5)从溶液中得到晶体的一般操作是蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠;
故答案为:冷却结晶;
(6)根据图像可知加入氢氧化钠时没有立即产生沉淀,这说明酸过量,首先发生酸碱中和;当沉淀不再发生变化时需要氢氧化钠是180mL;继续加入氢氧化钠沉淀开始减小,即氢氧化铝开始溶解,溶解氢氧化铝消耗的氢氧化钠溶液是40mL,则生成氢氧化铝消耗的氢氧化钠溶液体积是120mL,所以与铁离子反应的氢氧化钠溶液体积是60ml,物质的量是0.06mol/L×5mol/L=0.3mol,所以根据方程式Fe3++3OH=Fe(OH)3↓,所以铁离子是0.1mol,根据铁元素守恒可知,固体D中氢氧化铁的物质的量为0.1mol;沉淀达到最大值时溶液中的溶质是硫酸钠,则根据原子守恒可知硫酸钠的物质的量是![]() =0.5mol,则硫酸的浓度是
=0.5mol,则硫酸的浓度是![]() =2.5mol/L;
=2.5mol/L;
故答案是:2.5mol·L-1;0.10mol。


科目:高中化学 来源: 题型:
【题目】在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
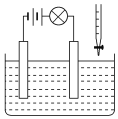
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入氢氧化钠溶液
C.石灰乳中逐滴加入稀盐酸
D.硫酸中逐滴加入氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s) ![]() NaOH(aq)
NaOH(aq)
B. Al(s)![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3(s)
Al(OH)3(s)
C. AgNO3(aq)![]() [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)![]() Ag(s)
Ag(s)
D. Fe2O3(s)![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列可逆反应:A(g)+B(g) ![]() xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
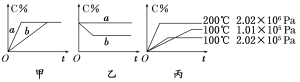
请根据图像回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则 曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性(与反应体系中任一物质均不反应)气体后的情况,则 曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是 热反应(填“吸”或“放”);
(4)化学计量数x的值 (填取值范围);判断的依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温常压下,32 g氧气所含的原子数为2NA
B.标准状况下,22.4 L 四氯化碳的分子数为NA
C.0℃,101 kPa下,44.8 L氮气所含有的原子数为2NA
D.常温常压下,1 mol氦气含有的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学给分子式为C12H26的某烷烃命名为“2,4-二甲基-3,5-二乙基己烷”,另一同学认为这样命名有错误,有关该烷烃的说法,你认为正确的是
A. 若该烷烃由单烯烃与氢气加成而得,则原单烯烃可有11种不同结构
B. 该烷烃的一氯代物有10种
C. 该烷烃正确名称应为2,4,5-三甲基-3-乙基庚烷
D. 该烷烃分子中含有5个支链
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有一定量的气体如下:①6.72LCH4、②3.01×1023个HCl分子、③13.6gH2S、④0.2molNH3,下列对这四种气体的关系从大到小排列的组合中正确的是( )
a.体积:②>③>①>④ b.密度:②>③>④>①
c.质量:②>③>①>④ d.氢原子个数:①>③>④>②
A.abcB.bcdC.abcD.abcd
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com