
【题目】将某些化学知识用图像表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,明显不正确的是( )

A. A B. B C. C D. D
【答案】A
【解析】
A.分散系的本质区别是分散质微粒直径的大小,分散质粒度小于1nm的为溶液,大于100nm的为浊液,介于1-100nm的为胶体,故A错误;B.盐酸溶液加水稀释溶液中离子浓度减小,溶液的导电能力逐渐减弱,故B正确;C.碳酸钠与盐酸先反应生成碳酸氢钠,碳酸氢钠再与盐酸反应生成二氧化碳,所以开始滴加盐酸,不会产生二氧化碳,一段时间后,开始产生二氧化碳,故C正确;D.先后发生的反应为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,生成沉淀过程消耗的NaOH与沉淀溶解消耗的NaOH体积比是3:1,故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充入2 mol A和1 mol B,在一定条件下发生反应:2A(g)+B(g)![]() 3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol /(L·s)
②用物质B表示该反应的平均反应速率为0.2 mol /(L·s)
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其它条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的铯(133Cs)原子钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒.已知该铯原子的核外电子数为55,则该原子的中子数和质子数之差为( )
A.23
B.55
C.78
D.133
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个2L的密闭容器中投入反应物,发生反应2SO3(g)![]() 2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
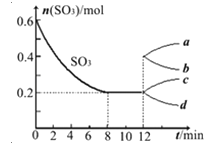
(1)根据8min时到达平衡,算出该反应的平衡常数值为 。
(2)用O2表示0到8min内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
A、v(SO3)=2v(O2)
B、容器内压强保持不变
C、v(SO2)逆=2v(O2)正
D、容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为 。
A、a B、b C、c D、d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向 反应方向移动(填“正”或“逆”)。SO3的体积分数 (填“增大”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室制取氨的是
A. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
B. 加热试管中的氯化铵固体
C. 将烧瓶中的浓氨水加热
D. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学取不同质量的镁铝合金样品分别与30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
实验序号 | a | b | c |
合金质量/mg | 510 | 765 | 918 |
气体体积/mL | 560 | 672 | 672 |
通过计算求:
(1)该盐酸的物质的量浓度
(2)合金中镁的质量分数
(3)在c组实验后,还需向容器中加入多少毫升同浓度的盐酸才能使剩余合金恰好完全溶解?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)![]() Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-
Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-![]() [Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
[Fe(SCN)] 2+(红色),K=138。下列说法不正确的是( )
A.边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀
B.当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点
C.上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+
D.滴定时,必须控制溶液一定的酸性,防止Fe3+水解,影响终点的观察
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com