
A、B、C、X均为中学化学常见的物质,它们之间有如下转化关系(其它产物已略去):
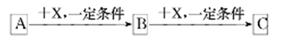
下列说法不正确的是
A.若A是NH3则C可能是氧化物
B.若A是非金属单质,则C与水反应的生成物为强酸
C若X是金属单质,则B、C 中X的化合价可能是B>C
D.若X是强碱,则B可能是两性物质
【知识点】常见物质的性质D3 D4 C2
【答案解析】B 解析:A、A、B、C、X可以分别为氨气、一氧化氮、二氧化氮、氧气,故A正确;B、A、B、C、X可以分别为硫、二氧化硫、三氧化硫、氧气,C与水反应的生成物为强酸;或A、B、C、X可以分别为碳、一氧化碳、二氧化碳、氧气,C与水反应的生成物为弱酸,故B错误;C、A、B、C、X可以分别为氯气、氯化铁、氯化亚铁、铁,则B、C 中铁的化合价B>C,故C正确;D、A、B、C、X可以分别为铝、氢氧化铝、偏铝酸钠、氢氧化钠,氢氧化铝是两性物质,故D正确。
故答案选B
【思路点拨】本题借助典型推断考查了中学常见物质的性质,平时要对连续反应等典型推断进行归纳,可以利用列举法解答。


科目:高中化学 来源: 题型:
图甲、图乙分别表示反应CO2(g)+H2(g) CO(
CO( g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是
g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是
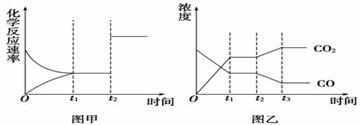
A.图甲中t2时刻发生改变的条件是增大反应物的浓度
B.图甲中t2时刻发生改变的条件可能是增大压强
C.图乙中t2时刻发生改变的条件是升高温度
D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修5:有机化学基础】(15分)
化合物G的合成路线如下:
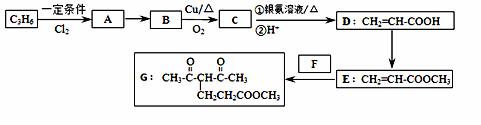
(1)D中含氧官能团的名称为 ,1 mol G发生加成反应最多消耗 mol H2 。
(2)除掉E中含有少量D的试剂和分离方法分别是 , ;
(3)下列说法正确的是 (填字母序号)。
a.A易溶于水
b.只用溴水即可确定C中含有碳碳双键
c.E经加聚、碱性条件下水解,所得高聚物可做具有高吸水性能的树脂
d.E是CH2=CHCOOCH2CH3的同系物
(4)写出A→B的化学反应方程式 ;
写出C和银氨溶液反应的离子方程式 。
(5)反应E + F→ G属于下列麦克尔加成反应类型,则F的结构简式为 。

(6)比G少2个氢原子的物质具有下列性质:①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有一种;③1mol物质最多可消耗2mol Na和1mol NaOH。任写一种该物质的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述,正确的是 (填序号,多选一个倒扣1分)
A.分液时,分液漏斗下层液体从下口放出,上层液体从上端口倒出
B.氢气还原氧化铜实验中,先加热氧化铜后通氢气
C.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
D.实验室做钠的实验时,余下的钠屑投入到原试剂瓶中
E.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
F.不慎将苯酚沾到皮肤上,立即用酒精清洗;
G.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入浓硝酸中,并不断搅拌;
H.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质,不能按 (“
(“ ”表示反应一步完成)关系转化的是
”表示反应一步完成)关系转化的是
| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | Al | Al(OH)3 | Al2O3 |
| D | MgCl2 | Mg(OH)2 | MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,4 gCH4含有NA个C-H共价键
B. 1 mol Fe与足量稀HNO3反应,转移2NA个电子
C.1 L 0. 1 mol/L NaHCO3溶液中含有0. 1NA个HCO3-
D.常温常压下,22.4 LNO2和CO2的混合气体中含有2NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。
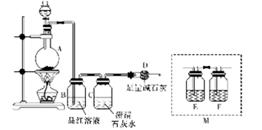
往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯。
(1)装置B的作用是______________________________________。
(2)甲同学观察到装置C中有白色沉淀生成。他得出了使澄清石灰水变浑浊的气体是二氧化碳的结论。装置A中能产生二氧化碳的化学方程式为_______________。
(3)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B~C之间添加装置M,装置E、F中盛放的试剂分别是_____、__________。重新实验后观察到装置F中的现象是_______________________________。
(4 )有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定
(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂铜粉使溶液中的Fe3+完全转化为Fe2+过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL。
①步骤II中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是___________________。
②滴定过程中_______________(填“需要”或“不需要")加入指示剂。
③铁碳合金中铁元素的质最分数为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一水草酸钙(CaC2O4·H2O)可用作分离稀有金属的载体。其制备方法如下:
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中。
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品。
(1)写出步骤Ⅱ发生反应的化学方程式 。
(2)已知CaC2O4·H2O的Ksp = 2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(Ca2+)的范围为 。
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率( )随温度的变化如下图所示。
)随温度的变化如下图所示。
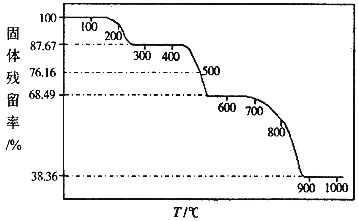
①300℃时残留固体的成分为 ,900℃时残留固体的成分为 。
②通过计算求出500℃时固体的成分及质量。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 AlC13溶液中:H+、Na+、Cl-、SO42-
B.含有0.1mol·L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3-
C.使甲基橙变红色的溶液中:Fe2+、K+、NO3-、SO42-
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com