
| A. | 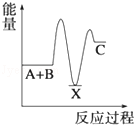 | B. | 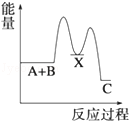 | C. |  | D. | 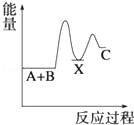 |
分析 根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题.
解答 解:由反应 A+B→C(△H>0)分两步进行:①A+B→X(△H<0),②X→C(△H>0),
由A+B→C(△H>0)是吸热反应,A和B的能量之和小于C;
由①A+B→X (△H<0)可知这步反应是放热反应,故X的能量小于A+B;
由②X→C(△H>0)可知这步反应是吸热反应,故X的能量小于C;
所以图象A符合,
故选A.
点评 本题依据图象主要考查了物质的能量分析应用,注意反应热与物质总能量大小的关系判断是解答本题的关键题目难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
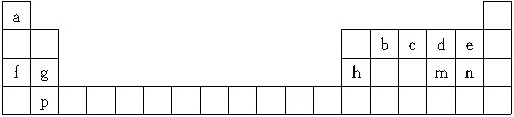
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
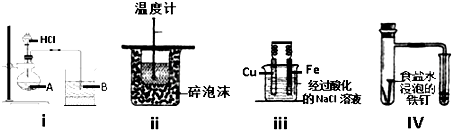
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、Al Cl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | NaCO3溶液中加入稀H2SO4 | 比较碳、硫的非金属性强弱 |
| D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.2NA个NH3分子的质量为3.4g | |
| B. | 2.7g金属铝所含电子数目为0.3NA | |
| C. | 7.1 g Cl2变为氯离子时,得到的电子数一定为0.1NA | |
| D. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com