
【题目】PBS是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成:

(已知:![]() +
+
![]()
 )
)
(1)A→B的反应类型是____________;B的结构简式是______________________。
(2)C中含有的官能团名称是________;D的名称(系统命名)是____________。
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含—O—O—键。半方酸的结构简式是___________________。
(4)由D和B合成PBS的化学方程式是______________________________________。
(5)下列关于A的说法正确的是__________。
a.能使酸性KMnO4溶液或溴的CCl4溶液褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制Cu(OH)2反应
d.1molA完全燃烧消耗5molO2
【答案】加成反应(或还原反应) HOOCCH2CH2COOH 碳碳叁键、羟基 1,4-丁二醇 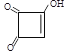 nHOOCCH2CH2COOH+nHOCH2CH2CH2CH2OH
nHOOCCH2CH2COOH+nHOCH2CH2CH2CH2OH![]()
![]() +2nH2O
+2nH2O
[或nHOOCCH2CH2COOH+nHOCH2CH2CH2CH2OH![]()
![]() +(2n-1)H2O] ac
+(2n-1)H2O] ac
【解析】
⑴由图知A![]() B,C
B,C![]() D是A、C与H2发生加成反应,分别生成B:HOOC(CH2)2COOH、D:HO(CH2)4OH,为二元醇,其名称为1,4-丁二醇。。⑵由已知信息及D的结构简式可推知C由两分子甲醛与HC≡CH加成而得,其结构为HOCH2C≡CCH2OH,分子中含有碳碳叁键和羟基。⑶根据题意马来酸酐共含4个碳原子,其不饱和度为4,又知半方酸含一个4元碳环,即4个原子全部在环上,又只含有一个-OH,因此另两个氧原子只能与碳原子形成碳氧双键,剩下的一个不饱和度则是一个碳碳双键提供,结合碳的四价结构可写出半方酸的结构简式为
D是A、C与H2发生加成反应,分别生成B:HOOC(CH2)2COOH、D:HO(CH2)4OH,为二元醇,其名称为1,4-丁二醇。。⑵由已知信息及D的结构简式可推知C由两分子甲醛与HC≡CH加成而得,其结构为HOCH2C≡CCH2OH,分子中含有碳碳叁键和羟基。⑶根据题意马来酸酐共含4个碳原子,其不饱和度为4,又知半方酸含一个4元碳环,即4个原子全部在环上,又只含有一个-OH,因此另两个氧原子只能与碳原子形成碳氧双键,剩下的一个不饱和度则是一个碳碳双键提供,结合碳的四价结构可写出半方酸的结构简式为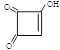 。⑷由题知B[HOOC(CH2)2COOH]为二元羧酸,D[HO(CH2)4OH]为二元醇,两者发生缩聚反应生成PBS聚酯。⑸A中含有碳碳双键,故能被KMnO4溶液氧化而使酸性KMnO4溶液褪色、与Br2发生加成反应使Br2的CCl4溶液褪色、与HBr等加成;因分子中含有-COOH,可与Cu(OH)2、Na2CO3等发生反应;由A(分子式为C4H4O4)完全燃烧:C4H4O4+3O2=4CO2+2H2O可知1molA消耗3 mol O2,故ac正确。
。⑷由题知B[HOOC(CH2)2COOH]为二元羧酸,D[HO(CH2)4OH]为二元醇,两者发生缩聚反应生成PBS聚酯。⑸A中含有碳碳双键,故能被KMnO4溶液氧化而使酸性KMnO4溶液褪色、与Br2发生加成反应使Br2的CCl4溶液褪色、与HBr等加成;因分子中含有-COOH,可与Cu(OH)2、Na2CO3等发生反应;由A(分子式为C4H4O4)完全燃烧:C4H4O4+3O2=4CO2+2H2O可知1molA消耗3 mol O2,故ac正确。
考点定位:本题以可降解的高分子材料为情境,考查炔烃、酸、醇、酯等组成性质及其转化,涉及有机物的命名、结构简式、反应类型及化学方程式的书写等多个有机化学热点和重点知识。能力层面上考查考生的推理能力,从试题提供的信息中准确提取有用的信息并整合重组为新知识的能力,以及化学术语表达的能力。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出8种元素在周期表中的位置。用化学用语回答下列问题:

⑴8种元素中,原子半径最小的是____,原子半径最大的是____,组成物质性质最稳定的是_____。
⑵由⑤组成的单质存在同素异形现象,所组成的同素异形体有:_________;
⑶⑥、⑦两种元素最高价氧化物对应的水化物中,碱性由强到弱的的是__________。
⑷元素⑧的氢化物的化学式为__________。该氢化物的主要用途:用作试剂、航空燃料。写出该氢化物在空气中燃烧的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH为___,表示其中和热的热化学方程式为_______________。
(2)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的燃烧热为____kJ·mol-1,该反应的热化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物的说法正确的是
A. 乙烯使酸性![]() 溶液和溴的
溶液和溴的![]() 溶液褪色的原理相同
溶液褪色的原理相同
B. 苯与液溴在催化剂作用下生成溴苯发生了加成反应
C. 淀粉、蛋白质等营养物质在人体内最终生成二氧化碳和水排出体外
D. 用![]() 法检验司机是否酒驾利用了乙醇的挥发性和还原性
法检验司机是否酒驾利用了乙醇的挥发性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓( GaN)是制造SG芯片的材料,氮化铝LED灯可发出紫外光。回答下列问题:
(1) Ga的价电子排布式为____,该基态原子占据最高能级的电子云轮廓图形状为________。
下列状态的铝中,电离最外层的一个电子所需能量最小的是____(填字母)。
![]()
(2)8 -羟基喹啉铝常用于发光材料及电子传输材料,可由LiAlH4与 合成。LiAlH4中阴离子的空间构型为_____________,
合成。LiAlH4中阴离子的空间构型为_____________, 所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
所含元素中电负性最大的是____(填元素符号),N的杂化方式为________________
(3)金属晶体Al、Ga的熔点分别为660℃、30℃,Al比Ga熔点高的原因是____________
(4)氮化镓为六方晶胞,结构如右图所示。该晶体密度为ρg/cm3,晶胞参数a=b≠c(单位:pm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=____pm(用含a、ρ、NA的代数式表示)。

(5)在立方晶胞中,与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面。如右图,该立方晶胞中(1,1,1)晶面共有____个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
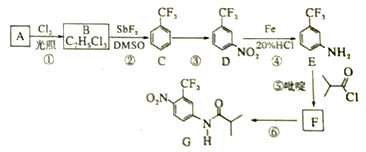
回答下列问题:
(1)A的结构简式为_______________。C的化学名称是________________________。
(2)③的反应试剂和反应条件分别是______________________,该反应的类型是___________。
(3)⑤的反应方程式为_____________________________________________。
吡啶是一种有机碱,其作用是______________________________。
(4)G的分子式为______________________________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则Ⅱ可能的结构有_________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
)制备小甲氧基乙酸苯胺的合成路线(其他试剂任选)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2(g)+3H2(g)2NH3(g),在1L密闭容器中进行,5min内氨的物质的量增加了0.2mol,则反应速率为( )
A. v(H2)=0.015mol/(L·min)B. v(N2)=0.02mol/(L·min)
C. v(NH3)=0.17mol/(L·min)D. v(NH3)=0.01mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z与Y形成的化合物的化学式为YZ。下列说法不正确的是()
A.W在元素周期表中的位置是第二周期第VA族
B.同主族中Z的气态氢化物稳定性最强
C.X与Y形成的两种常见的化合物中,阳离子和阴离子的个数比均为2∶1
D.用电子式表示YZ的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com