
【题目】已知反应:NO2(g) + SO2(g)![]() SO3(g) + NO(g) ,起始时向某密闭容器中通入1 mol NO2 、 2 mol S18O2,.反应达到平衡后,下列有关说法正确的是:
SO3(g) + NO(g) ,起始时向某密闭容器中通入1 mol NO2 、 2 mol S18O2,.反应达到平衡后,下列有关说法正确的是:
A.NO2中不可能含18OB.有1 mol N18O生成
C.S18O2的物质的量不可能为0. 8 molD.SO2、SO3、NO、NO2均含18O时,说明该反应达到平衡
【答案】C
【解析】
A.NO2(g) + SO2(g)![]() SO3(g) + NO(g) 反应到达平衡后,化学平衡是一个动态平衡,故NO2中可能含18O,A错误;
SO3(g) + NO(g) 反应到达平衡后,化学平衡是一个动态平衡,故NO2中可能含18O,A错误;
B.NO2(g) + SO2(g)![]() SO3(g) + NO(g)该反应是可逆反应, NO2的转化率小于100%,故生成 N18O的物质的量小于1mol,B错误;
SO3(g) + NO(g)该反应是可逆反应, NO2的转化率小于100%,故生成 N18O的物质的量小于1mol,B错误;
C.反应物的物质的量变化量之比等于化学计量数之比,又因为NO2(g) + SO2(g)![]() SO3(g) + NO(g)这个反应是可逆反应,NO2的转化率小于100%,故平衡时 S18O2的物质的量大于1.0mol,C正确;
SO3(g) + NO(g)这个反应是可逆反应,NO2的转化率小于100%,故平衡时 S18O2的物质的量大于1.0mol,C正确;
D.反应物、生成物的物质的量不在随着时间的改变而改变,当SO2、SO3、NO、NO2均含18O时,不能说明反应达到平衡,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】研究含碳化合物的结构与性质,对生产、科研等具有重要意义。
(1)某同学画出基态碳原子的核外电子排布图:![]() ,该电子排布图违背了__;CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+、CH3-的空间构型分别为___、____。
,该电子排布图违背了__;CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+、CH3-的空间构型分别为___、____。
(2)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
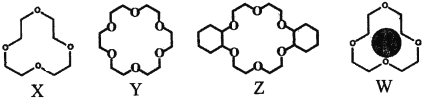
①Li+与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态锂离子核外能量最高的电子所处能层符号为___________;
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构。理由是___________。
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶入冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是___________,H-O键键角___________(填“>”“<”或“=”)109°28′
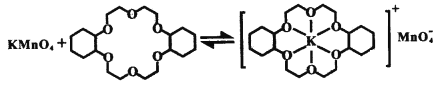
ii.已知:冠醚Z与KMnO4可以发生下图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色 | I的还原性强于Cl |
B | 向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液,紫红色褪去 | 该气体一定是乙烯 |
C | 测定Na2CO3和Na2SiO3溶液的pH,后者pH比前者的大 | C的非金属性比Si强 |
D | 向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成 | 1-溴丙烷没有水解 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。请回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为: FeC2O4+K3[Fe(CN)6] →Fe3[Fe(CN)6]2+______,配平并完成该显色反应的化学方程式。
2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为: FeC2O4+K3[Fe(CN)6] →Fe3[Fe(CN)6]2+______,配平并完成该显色反应的化学方程式。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
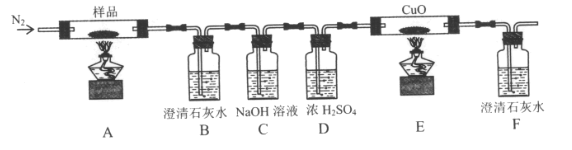
①通入氮气的目的是_________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有_______,____。
③样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(1)盐酸浸取时需要适当加热的原因是_________。
(2)用37%的盐酸配制15%的盐酸需用到的仪器有________(填字母)
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(3)滤渣I的成分为__________;
(4)Mg(OH)2的溶度积常数Ksp=_______,加入H2C2O4时发生的离子反应为_______,加入H2C2O4应避免过量,其原因是_________。
(5)母液中除了含有Ba2+、Cl—外,还含有大量的_________(填离子符号);
(6)滤渣III(不含结晶水)是结石的主要成分滤渣Ⅲ经过洗涤干燥后在空气中进行热重分析,取128.0g该纯净物,在200~470℃灼烧,最后得到100.0g产物,200~470℃时发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①不同核素之间形成的共价键一定是极性键②当一个碳原子连接四个不同的原子或原子团时,该碳原子叫手性碳原子③Ge是ⅣA族的一个主族元素,其核外电子排布式为Ge:[Ar]4s24p2,属于P区元素④非极性分子往往是高度对称的分子,比如BF3,PCl5,H2O,CO2这样的分子⑤冰中存在极性共价键和氢键两种化学键的作用⑥熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、电解质、盐⑦氨水中大部分NH3与H2O以氢键(用“ …”表示)结合成NH3H2O分子,根据氨水的性质可知NH3H2O的结构式为⑧σ键重叠方式为头碰头,成镜像对称;键重叠方式为肩并肩,成轴对称⑨干冰汽化破坏了共价键,氯化钠溶于水破坏了离子键.
…”表示)结合成NH3H2O分子,根据氨水的性质可知NH3H2O的结构式为⑧σ键重叠方式为头碰头,成镜像对称;键重叠方式为肩并肩,成轴对称⑨干冰汽化破坏了共价键,氯化钠溶于水破坏了离子键.
A. ②⑥B. ①②⑥C. ②⑤⑥⑧D. ③④⑥⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是

A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将pH=8的NaOH溶液稀释1000倍,稀释后溶液中c(Na+)与c(OH-)之比接近
A. 1:1 B. 1:102 C. 102:1 D. 1:103
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com